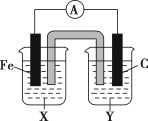
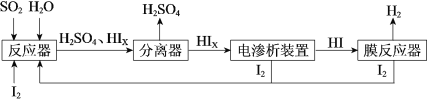
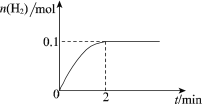
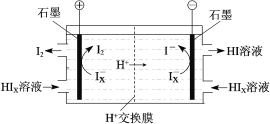
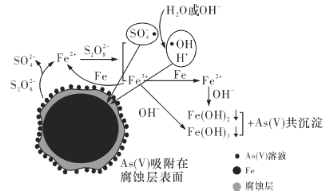
题目内容
【题目】X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y基态原子的3p轨道上有2个未成对电子。元素Z 的原子最外层电子数是其内层的3倍。回答下列问题:
(1)元素X在元素周期表中位于___区,单质X的晶体类型为_____,其中X原子的配位数为_____。
(2)Z的氢化物在乙醇中的溶解度大于Y的氢化物,其原因是__________。
(3)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为____________。
(4)X与Y形成的一种化合物的立方晶胞如图所示。
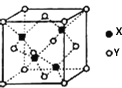
该化合物的化学式为_______,已知此晶体的密度为ρg·cm–3,阿伏伽德罗常数为NA,则此晶胞中X与Y的最近距离是______cm。(写出计算式,不要求计算结果。)
【答案】ds 金属晶体 12 水分子与乙醇分子间可形成氢键,而硅化氢或硫化氢不能,所以硅化氢或硫化氢在乙醇中的溶解度小于水的溶解度 16NA CuS 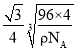
【解析】
由题意可知,元素X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子,则X的原子序数为(2+8+18+1)=29,则X为Cu元素;元素Y基态原子的3p轨道上有2个未成对电子,则Y为Si或S元素;元素Z的原子最外层电子数是其内层的3倍,则Z为O元素。
(1)Cu元素在元素周期表中位于ds区,单质铜为金属晶体,铜晶为六方最密堆积堆积,铜原子的配位数为12,故答案为:ds;金属晶体;12;
(2)Z为O元素,Y为Si或S元素,水分子与乙醇分子间可形成氢键,而硅化氢或硫化氢不能,所以硅化氢或硫化氢在乙醇中的溶解度小于水,故答案为:水分子与乙醇分子间可形成氢键,而硅化氢或硫化氢不能,所以硅化氢或硫化氢在乙醇中的溶解度小于水的溶解度;
(3)1mol配合物[X(NH3)4]Cl2中含有12molN-H键和4mol配位键,则σ键的数目为16NA,故答案为:16NA;
(4)由晶胞结构可知,X为Cu元素、Y为S元素,每个晶胞中含有铜原子个数为:8×![]() +6×
+6×![]() =3,硫原子个数为4,则化学式为;CuS;晶胞中含有4个CuS,设X与Y的最近距离是d cm,晶胞边长为a cm,由X与Y的最近距离可知体对角线的长度为4dcm,则晶胞的边长为
=3,硫原子个数为4,则化学式为;CuS;晶胞中含有4个CuS,设X与Y的最近距离是d cm,晶胞边长为a cm,由X与Y的最近距离可知体对角线的长度为4dcm,则晶胞的边长为![]() dcm,由晶胞的质量可得(
dcm,由晶胞的质量可得(![]() dcm)3ρ=
dcm)3ρ=![]() ,解得d=
,解得d=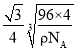 cm,故答案为:
cm,故答案为: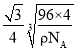 。
。

【题目】苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:![]()
![]()
![]() +H2(g)
+H2(g)
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ/mol | 412 | 348 | 612 | 436 |
计算上述反应生成1mol氢气的热效应___(填吸放多少kJ)
(2)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图。
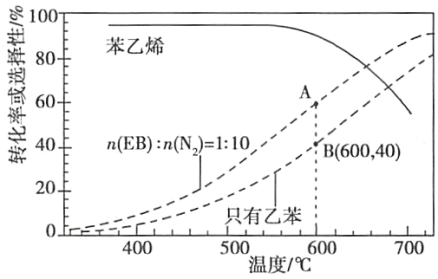
①A、B两点对应的正反应速率较大的是___。
②控制反应温度为600℃的理由是___。