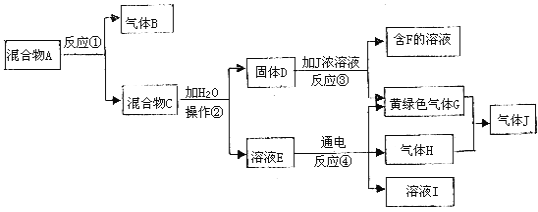
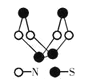
题目内容
【题目】化学电池的发明,是贮能和供能技术的巨大进步。
(1)如图所示装置中,Zn片是_____ (填“正极”或“负极”),Cu片上发生的电极反应为_____。

(2)该装置是典型的原电池装置,可将氧化还原反应释放的能量直接转变为电能,能证明产生电能的实验现象是_____。
(3)2019年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如图:
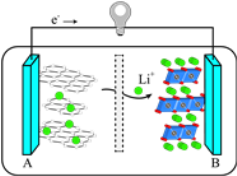
下列说法不正确的是_____(填序号)。
①A为电池的正极
②该装置实现了电能转化为化学能
③电池工作时,电池内部的锂离子定向移动
【答案】负极 2H++2e-=H2↑ 电流表指针发生偏转 ①②
【解析】
(1)由图可知,活泼金属锌做原电池的负极,不活泼金属铜做原电池的正极;
(2)由图可知,该装置为铜锌硫酸原电池,该装置实现了电能转化为化学能;
(3)由图给示意图可知,该装置为原电池,由电子和锂离子的移动方向可知,A电极为电源的负极,B为电源的正极,电池工作时,锂离子向正极B电极移动。
(1)由图可知,活泼金属锌做原电池的负极,不活泼金属铜做原电池的正极,氢离子在正极上得到电子发生还原反应生成氢气,电极反应式为2H++2e-=H2↑,故答案为:负极;2H++2e-=H2↑;
(2)由图可知,该装置为铜锌硫酸原电池,该装置实现了电能转化为化学能,能证明产生电能的实验现象为电流表指针发生偏转,故答案为:电流表指针发生偏转;
(3)由图给示意图可知,该装置为原电池,由电子和锂离子的移动方向可知,A电极为电源的负极,B为电源的正极,电池工作时,锂离子向正极B电极移动,则①②错误,故答案为:①②。

练习册系列答案
相关题目