题目内容
【题目】据公安部2019年12月统计,2019年全国机动车保有量已达3.5亿。汽车尾气排放的碳氢化合物、氮氧化物及碳氧化物是许多城市大气污染的主要污染物。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
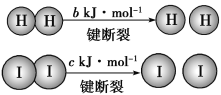
(1)已知:C(s)+O2(g)=CO2(g) △H1=393.5kJ·mol1
2C(s)+O2(g)=2CO(g) △H2=221.0kJ·mol1
N2(g)+O2(g)=2NO(g) △H3=+180.5kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式___。
(2)对于2NO(g)+2CO(g)![]() N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
下列能说明该反应已经达到平衡状态的是___(填字母代号)。
A.![]() 比值不变
比值不变
B.容器中混合气体的密度不变
C.v(N2)正=2v(NO)逆
D.容器中混合气体的平均摩尔质量不变
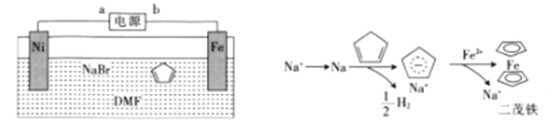
(3)使用间接电化学法可处理燃煤烟气中的NO,装置如图2所示。
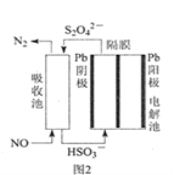
已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式___。用离子方程式表示吸收池中除去NO的原理___。
(4)T1温度时在容积为2L的恒容密闭容器中发生反应:2CO(g)+O2(g)![]() 2CO2(g) △H<0。实验测得:v正=v(CO)消耗=2v(O2)消耗=k正c2(CO)·c(O2),v逆=(CO2)消耗=k逆c2(CO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(CO)、n(O2)如表:
2CO2(g) △H<0。实验测得:v正=v(CO)消耗=2v(O2)消耗=k正c2(CO)·c(O2),v逆=(CO2)消耗=k逆c2(CO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(CO)、n(O2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(CO)/mol | 2 | 1.2 | 0.8 | 0.4 | 0.4 | 0.4 |
n(O2)/mol | 1.2 | 0.8 | 0.6 | 0.4 | 0.4 | 0.4 |
①T1温度时![]() =___L/mol。
=___L/mol。
②若将容器的温度改变为T2时其k正=k逆,则T2__T1(填“>”、“<”或“=")。
II.“低碳经济”备受关注,CO2的有效开发利用成为科学家研究的重要课题。在0.1MPa、Ru/TiO2催化下,将一定量的H2和CO2置于恒容密闭容器中发生反应X:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H<0
CH4(g)+2H2O(g) △H<0
(5)温度为T时,向10L密闭容器中充入5molH2和CO2的混合气体,此时容器内压强为5P,两种气体的平衡转化率ɑ与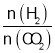 的关系如图所示:
的关系如图所示:
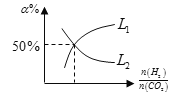
①图中CO2的平衡转化率可用表示___(L1或L2)
②该温度下,反应X的平衡常数Kp=___。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746.5kJ/mol AD 2![]() +2e-+2H+=
+2e-+2H+=![]() +2H2O 2NO+2S2O42-+2H2O=N2+4HSO3- 80 > L1
+2H2O 2NO+2S2O42-+2H2O=N2+4HSO3- 80 > L1 ![]()
【解析】
(1)根据盖斯定律计算反应热,完成热化学方程式书写;
(2)化学平衡状态的判断要依据正逆反应速率相等,各组分的浓度不变来分析判断;
(3)结合图示信息确定吸收室中的反应物和产物,以及阴极的反应物和产物,依据电子得失守恒以及元素守恒完成反应方程式的书写;
(4)根据表达式,结合平衡时正逆反应速率相等,确定平衡常数与正逆速率常数之间的关系,利用表格数据列出三段式,求解平衡常数,根据温度改变平衡常数改变,由不同温度时平衡常数的大小确定温度的变化情况;
(5)根据浓度对平衡的影响分析反应物比值改变时的转化率变化,借助特殊的交点数据列三段式求解Kp。
(1)将三个反应依次标记为I、II、III,根据盖斯定律热化学方程式2NO(g)+2CO(g)=N2(g)+2CO2(g),可由![]() 得到,则ΔH=
得到,则ΔH=![]() =
=![]() =-746.5kJ/mol,则该反应的热化学方程式为2NO(g)+2CO(g)=N2(g)+2CO2(g)ΔH=-746.5kJ/mol,故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g)ΔH=-746.5kJ/mol;
=-746.5kJ/mol,则该反应的热化学方程式为2NO(g)+2CO(g)=N2(g)+2CO2(g)ΔH=-746.5kJ/mol,故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g)ΔH=-746.5kJ/mol;
(2)A.反应过程中NO的浓度在减小,二氧化碳的浓度在增大,则![]() 比值在反应过程中是变量,当比值不变时说明浓度不再改变,反应达到平衡,故A可判断;
比值在反应过程中是变量,当比值不变时说明浓度不再改变,反应达到平衡,故A可判断;
B.该反应前后各物质均为气体,气体质量保持不变,容器体积恒定,则密度始终保持恒定,故容器中混合气体的密度不变不能确定平衡状态,故B不可判断;
C.平衡时正逆反应速率相等,不同物质间速率要满足化学计量数之比,即2v(N2)正=v(NO)逆时反应达平衡状态,故C不能判断;
D.反应前后气体质量不变,该反应正向气体分子数减小,反应过程中容器中混合气体的平均摩尔质量逐渐增大,当平均摩尔质量不变时反应达到平衡,故D可判断。
故答案为:AD;
(3)由电解装置可知左侧Pb为阴极,阴极上发生![]() 转变为
转变为![]() 的反应,电解为弱酸性环境,则电极反应式为:2
的反应,电解为弱酸性环境,则电极反应式为:2![]() +2e-+2H+=
+2e-+2H+=![]() +2H2O;吸收室中发生NO和
+2H2O;吸收室中发生NO和![]() 产生
产生![]() 和氮气的反应,反应方程式为2NO+2S2O42-+2H2O=N2+4HSO3-,故答案为: 2
和氮气的反应,反应方程式为2NO+2S2O42-+2H2O=N2+4HSO3-,故答案为: 2![]() +2e-+2H+=
+2e-+2H+=![]() +2H2O;2NO+2S2O42-+2H2O=N2+4HSO3-
+2H2O;2NO+2S2O42-+2H2O=N2+4HSO3-
(4)①v正=k正c2(CO)·c(O2),v逆=k逆c2(CO2),当反应达平衡时v正= v逆,则k正c2(CO)·c(O2)= k逆c2(CO2),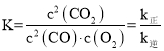 。
。
根据表格信息,T1时反应3s达到平衡状态,c(CO)=![]() , c(O2)=0.2mol/L,结合反应可知二氧化碳的浓度变化量=一氧化碳的浓度变化量=1mol/L-0.2mol/L=0.8 mol/L,则该温度时的平衡常数K=
, c(O2)=0.2mol/L,结合反应可知二氧化碳的浓度变化量=一氧化碳的浓度变化量=1mol/L-0.2mol/L=0.8 mol/L,则该温度时的平衡常数K=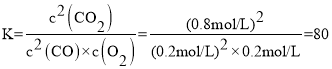 ,则该温度时
,则该温度时![]() =80,故答案为:80;
=80,故答案为:80;
②温度改变为T2时k正=k逆,即![]() =1,此时的平衡常数小于T1时的平衡常数,该反应为放热反应,温度升高平衡逆向移动平衡常数减小,因此T2大于T1,故答案为:>;
=1,此时的平衡常数小于T1时的平衡常数,该反应为放热反应,温度升高平衡逆向移动平衡常数减小,因此T2大于T1,故答案为:>;
(5)① 越大时,可视为是二氧化碳不变时增大氢气的物质的量,增大氢气的量平衡正向移动,二氧化碳的转化率增大,而氢气的转化率降低,故L1代表二氧化碳,L2代表氢气,故答案为:L1;
越大时,可视为是二氧化碳不变时增大氢气的物质的量,增大氢气的量平衡正向移动,二氧化碳的转化率增大,而氢气的转化率降低,故L1代表二氧化碳,L2代表氢气,故答案为:L1;
②温度为T不变时,平衡常数不变,取交点时计算,交点时两者的转化率均为50%,总气体为5mol,![]() =amol,则
=amol,则![]() =(5-a)mol,列三段式得:
=(5-a)mol,列三段式得:
CO2(g) | +4H2(g) | CH4(g) | +2H2O(g) | ||||
起始物质的量: | a | 5-a | |||||
转化物质的量: | 0.5a | 0.5(5-a) | 0.5a | a | |||
平衡物质的量: | 0.5a | 0.5(5-a) | 0.5a | a | |||
由变化量之比等于化学计量数之比得:![]() ,解得:a=1,代入三段式得,
,解得:a=1,代入三段式得,
CO2(g)+ | 4H2(g) | CH4(g)+ | 2H2O(g) | ||||||
起始物质的量: | 1 | 4 | |||||||
转化物质的量: | 0.5 | 2 | 0.5 | 1 | |||||
平衡物质的量: | 0.5 | 2 | 0.5 | 1 | |||||
起始物质的量为5mol时气体压强为5P,平衡时气体物质的量为4mol,则平衡时压强为4P,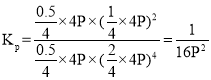 ,故答案为:
,故答案为:![]()

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案