题目内容
【题目】(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。刻蚀印刷电路板涉及的离子方程式为___,检验溶液中还有Fe3+的试剂是___。
(2)工业上制取漂白粉的化学反应方程式为___,漂白粉在空气中表现漂白性的原理是___,除去氯气中混有的氯化氢气体的方法是将气体通过___溶液中。
(3)铝分别与足量的NaOH溶液和稀硫酸反应,若两个反应在相同状况下放出等量的气体,则两个反应中消耗的铝的物质的量之比为___。
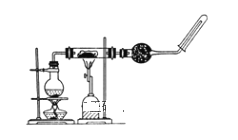
(4)玻璃烧制过程中发生的反应有___。
(5)在标准状况下,由CO和CO2组成的混合气体6.72L,质量为12g。此混合物中CO和CO2物质的量之比是___。
【答案】2Fe3++Cu=2Fe2++Cu2+ KSCN溶液 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Ca(ClO)2+CO2+H2O=2HClO+CaCO3 饱和食盐水 1:1 SiO2+Na2CO3![]() Na2SiO3+CO2 1:3
Na2SiO3+CO2 1:3
【解析】
(1)用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2,由反应物、生成物及电子、原子守恒书写离子方程式;
(2)工业上是利用氯气和石灰乳反应生成氯化钙、次氯酸钙和水;Ca(ClO)2和溶有CO2的H2O溶液反应生成HClO;氯化氢极易溶于水,氯气在饱和食盐水中溶解性减小;
(3)铝分别和足量的氢氧化钠和稀硫酸反应,如果生成相同条件下等量的氢气,这两个反应中都是铝失电子,且都是由0价升高到+3价,由电子守恒,可求出需要铝的物质的量;
(4)工业制玻璃主要原料有石英、纯碱和石灰石,碳酸钙和碳酸钠与二氧化硅在高温条件下反应生成硅酸盐和二氧化碳;
(5)根据n=![]() 计算混合气体的总的物质的量,设CO的物质的量为x mol,CO2的物质的量为y mol,根据质量之和与物质的量之和列式计算CO和CO2的物质的量,进而计算二者物质的量之比。
计算混合气体的总的物质的量,设CO的物质的量为x mol,CO2的物质的量为y mol,根据质量之和与物质的量之和列式计算CO和CO2的物质的量,进而计算二者物质的量之比。
(1) 用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2,由反应物、生成物及电子、原子守恒可知反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,检验Fe3+溶液的试剂是KSCN溶液,滴入KSCN溶液,溶液变红色证明含铁离子;
(2) 工业上是利用氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl 2+Ca(ClO)2+2H2O;漂白粉的有效成分Ca(ClO)2溶于水,和水中溶解的CO2反应生成HClO,HClO有强氧化性,具有漂白性,发生反应的化学方程式为Ca(ClO)2+CO2+H2O=2HClO+CaCO3↓;因氯气与水发生:Cl2+H2OH++Cl-+HClO,氯气难溶于饱和食盐水,但HCl极易溶于水,可用饱和食盐水除去氯气中少量的氯化氢气体;
(3) 铝分别和足量的氢氧化钠和稀硫酸反应,如果生成相同条件下等量的氢气,这两个反应中都是铝失电子,由转移电子守恒知,需要铝的物质的量之比为1:1;
(4)工业制玻璃主要原料有石英、纯碱和石灰石,碳酸钙和碳酸钠与二氧化硅在高温条件下反应生成硅酸盐和二氧化碳,发生反应的化学方程式为SiO2+Na2CO3![]() Na2SiO3+CO2或SiO2+CaCO3
Na2SiO3+CO2或SiO2+CaCO3![]() CaSiO3+CO2;
CaSiO3+CO2;
(5)标准状况下,混合气体的物质的量为:![]() =0.3mol;设CO的物质的量为x mol,CO2的物质的量为y mol,则:x+y=0.3、28x+44y=12,解得:x=0.075mol,y=0.225mol,此混合物中CO和CO2物质的量之比=0.075mol:0.225mol=1:3。
=0.3mol;设CO的物质的量为x mol,CO2的物质的量为y mol,则:x+y=0.3、28x+44y=12,解得:x=0.075mol,y=0.225mol,此混合物中CO和CO2物质的量之比=0.075mol:0.225mol=1:3。

【题目】将H2S转化为可再利用的资源是能源研究领域的重要课题。
(1)H2S的转化
Ⅰ | 克劳斯法 |
|
Ⅱ | 铁盐氧化法 |
|
Ⅲ | 光分解法 |
|
① 反应Ⅰ的化学方程式是________。
② 反应Ⅱ:____+ 1 H2S ==____Fe2+ + ____S↓ + ____(将反应补充完整)。
③ 反应Ⅲ体现了H2S的稳定性弱于H2O。结合原子结构解释二者稳定性差异的原因:_______。
(2)反应Ⅲ硫的产率低,反应Ⅱ的原子利用率低。我国科研人员设想将两个反应耦合,实现由H2S高效产生S和H2,电子转移过程如图。
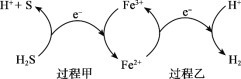
过程甲、乙中,氧化剂分别是______。
(3)按照设计,科研人员研究如下。
① 首先研究过程乙是否可行,装置如图。经检验,n极区产生了Fe3+,p极产生了H2。n极区产生Fe3+的可能原因:
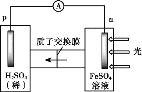
ⅰ.Fe2+ - e- = Fe3+
ⅱ.2H2O -4e-=O2 +4H+,_______(写离子方程式)。经确认,ⅰ是产生Fe3+的原因。过程乙可行。
② 光照产生Fe3+后,向n极区注入H2S溶液,有S生成,持续产生电流,p极产生H2。研究S产生的原因,设计如下实验方案:______。 经确认,S是由Fe3+氧化H2S所得,H2S不能直接放电。过程甲可行。
(4)综上,反应Ⅱ、Ⅲ能耦合,同时能高效产生H2和S,其工作原理如图。
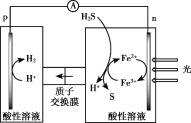
进一步研究发现,除了Fe3+/Fe2+ 外,I3-/I- 也能实现如图所示循环过程。结合化学用语,说明I3-/I- 能够使S源源不断产生的原因:________。