题目内容
4.将9.5g含有可溶性杂质的MgCl2全部溶于水中配制成溶液,向其中加入足量用稀硝酸酸化的AgNO3溶液,充分反应后,得到沉淀28g,则其中所含杂质不可能是( )| A. | NaCl | B. | AlCl3 | C. | CaCl2 | D. | FeCl3 |
分析 假设氯化镁中不含杂质,则9.5克可生成AgCl的质量为28.7g,现生成AgCl的质量为28g,说明杂质是含氯量小于MgCl2中含氯量,分别计算各选项中Cl的含量与氯化镁比较即可得出答案.
解答 解:9.5g MgCl2可生成AgCl的质量为:108g/mol×$\frac{9.5g}{95g/mol}$×2=28.7g,现生成AgCl的质量为28g,说明杂质中的含氯量小于MgCl2的含氯量,
氯化镁中Cl的含量为:$\frac{71}{95}$≈0.75,
A.NaCl中Cl的含量为:$\frac{35.5}{58.5}$≈0.61,小于氯化镁中Cl的含量,则杂质中可能含有NaCl,故A错误;
B.AlCl3中Cl的含量为:$\frac{35.5×3}{133.5}$≈0.80,大于氯化镁中Cl的含量,不可能含有氯化铝,故B正确;
C.CaCl2中Cl的含量为:$\frac{35.5×2}{111}$≈0.64,小于氯化镁中Cl的含量,可能含有氯化钙,故C错误;
D.FeCl3中Cl的含量为:$\frac{35.5×3}{162.5}$≈0.66,小于大于氯化镁中Cl的含量,可能含有氯化镁,故D错误;
故选B.
点评 本题考查了有关混合物反应的计算,题目难度中等,正确理解题干信息,得出杂质中氯元素含量大于氯化镁中氯元素含量为解答本题的关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.在一个1L的密闭容器中加入2molA和1molB,发生下述反应:2A(g)+B(g)?3C(g)+D(s)达到平衡时,C的浓度为1.2mol/L.维持容器的体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L的是( )
| A. | 4molA+2molB | B. | 3molB+1molD | ||
| C. | 2molA+1molB+3molC | D. | 1molA+0.5molB+1.5molC+0.6molD |
7.(1)已知:
①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)?CH3OH(g)△H3=-90.8kJ•mol-1
计算甲醇蒸气的燃烧热△H=-763.8kJ•mol-1
(2)在某温度下,发生可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.0kJ.mol-1
①向某容器中充入1.0molH2O(g)和1.0mol CO(g),在一定条件下发生上述反应.混合气体中CO的物质的量与时间关系如下表所示:
相对实验Ⅰ,实验Ⅱ可能改变的条件可能是增大压强(或缩小体积)、加催化剂,该温度下,平衡常数=1.
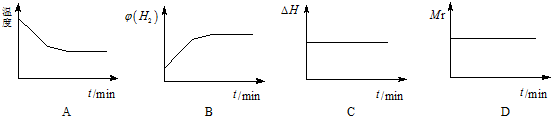
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应.下列图象正确且说明可逆反应达到平衡状态的是A.(填序号)(Mr为反应混合物的平均相对分子质量)
(3)对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的.汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ N2(g)+2CO2(g)△H=-QkJ/mol.
一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
前2s内的平均反应速率υ(N2)=1.88×10-4mol/(L•s);
达到平衡时,CO的转化率为25%.
(4)氨气是重要化工原料,在国民经济中占重要地位.在恒温、容积相等的恒容密闭容器中投入一定量氮气、氢气,发生如下可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.40kJ.mol-1 实验测得起始、平衡时的有关数据如表所示:
下列判断正确的是BC.
A.N2的转化率:Ⅱ>Ⅰ>ⅢB.放出热量:a<b<92.4n
C.达到平衡时氨气的体积分数:Ⅲ>ⅠD.平衡常数:Ⅲ>Ⅱ>Ⅰ
①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)?CH3OH(g)△H3=-90.8kJ•mol-1
计算甲醇蒸气的燃烧热△H=-763.8kJ•mol-1
(2)在某温度下,发生可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.0kJ.mol-1
①向某容器中充入1.0molH2O(g)和1.0mol CO(g),在一定条件下发生上述反应.混合气体中CO的物质的量与时间关系如下表所示:
| 0 | 5min | 10min | 15min | 20min | 25min | |
| Ⅰ(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
| Ⅱ(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应.下列图象正确且说明可逆反应达到平衡状态的是A.(填序号)(Mr为反应混合物的平均相对分子质量)

(3)对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的.汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ N2(g)+2CO2(g)△H=-QkJ/mol.
一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
达到平衡时,CO的转化率为25%.
(4)氨气是重要化工原料,在国民经济中占重要地位.在恒温、容积相等的恒容密闭容器中投入一定量氮气、氢气,发生如下可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.40kJ.mol-1 实验测得起始、平衡时的有关数据如表所示:
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| H2 | N2 | NH3 | ||
| Ⅰ | 3 n | n | 0 | 放出热量a kJ |
| Ⅱ | 3 n | 2 n | 0 | 放出热量b kJ |
| Ⅲ | 6 n | 2 n | 0 | 放出热量c kJ |
A.N2的转化率:Ⅱ>Ⅰ>ⅢB.放出热量:a<b<92.4n
C.达到平衡时氨气的体积分数:Ⅲ>ⅠD.平衡常数:Ⅲ>Ⅱ>Ⅰ
 如图所示的装置,接通电源5min后,电极3的质量增加了0.64g.
如图所示的装置,接通电源5min后,电极3的质量增加了0.64g. 氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义. 氨既是实验室中常用试剂,也是工业上重要原料.
氨既是实验室中常用试剂,也是工业上重要原料.