题目内容
4. 氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.(1)图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234KJ/mol.
(2)已知:N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746kJ•mol-1
则反应CO(g)+1/2O2(g)═CO2(g)的△H=-283 kJ•mol-1
(3)在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0;
①该反应的平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$;
②若5分钟末达到平衡,此时测得体系压强是开始时的0.7倍,则平衡时H2的转化率为36%;
③平衡常数K与温度T的关系如表:则 K1>K2(填写“>”、“=”或“<”)
| T/K | 398 | 498 |
| 平衡常数K | K1 | K2 |
分析 (1)由图可知,1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)放出热量为368kJ-134kJ=234kJ,注明物质的聚集状态与反应热书写热化学方程式;
(2)已知:①N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
②2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746kJ•mol-1
根据盖斯定律,(①+②)÷2可得:CO(g)+$\frac{1}{2}$O2(g)═CO2(g);
(3)①化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
②若5分钟末达到平衡,此时测得体系压强是开始时的0.7倍,则平衡时混合气体总物质的量为(0.2+0.6)mol×0.7=0.56mol,利用差量法计算参加反应氢气的物质的量,进而计算氢气的转化率;
③正反应为放热反应,升高温度平衡逆向移动,平衡常数减小.
解答 解:(1)由图可知,1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)放出热量为368kJ-134kJ=234kJ,热化学方程式为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234KJ/mol,
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234KJ/mol;
(2)已知:①N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
②2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746kJ•mol-1
根据盖斯定律,(①+②)÷2可得:CO(g)+$\frac{1}{2}$O2(g)═CO2(g),则△H=$\frac{1}{2}$×(180kJ•mol-1-746kJ•mol-1)=-283kJ•mol-1,
故答案为:-283;
(3)①N2(g)+3H2(g)?2NH3(g)的化学平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$,
故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$;
②若5分钟末达到平衡,此时测得体系压强是开始时的0.7倍,则平衡时混合气体总物质的量为(0.2+0.6)mol×0.7=0.56mol,则:
N2(g)+3H2(g)?2NH3(g)物质的量减小△n
3 2
0.36mol 0.8mol-0.56mol=0.24mol
故氢气的转化率为$\frac{0.36mol}{0.6mol}$×1005=36%,
故答案为:36%;
②正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,故平衡常数K1>K2,
故答案为:>.
点评 本题考查化学平衡计算、平衡常数及影响因素、热化学方程式、盖斯定律应用等,(3)中计算注意差量法的应用,难度中等.

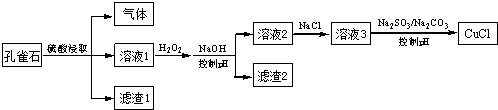
下列说法不正确的是( )
| A. | H2O2将溶液1中Fe2+氧化为Fe3+,再通过控制pH转化为Fe(OH)3除去 | |
| B. | SO32-将溶液3中的Cu2+还原,反应得到CuCl | |
| C. | CO32-作用是控制溶液pH,促使CuCl沉淀的生成 | |
| D. | 若改变试剂加入顺序,将溶液3缓慢加入到含大量SO32-/CO32-的溶液中,同样可制取CuCl |
| A. | NaCl | B. | AlCl3 | C. | CaCl2 | D. | FeCl3 |
| T/℃ | 30 | 40 | 50 | 60 |
| NH3生成量/10-6 mol | 4.8 | 5.9 | 6.0 | 6.1 |

回答下列问题:
(1)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化的示意图,并进行必要标注.
(2)与目前广泛使用的工业合成氨方法相比,该方法固氮反应速率慢.请提出可提高其反应速率且增大NH3生成量的建议:升高温度,增大反应物N2的浓度,不断移出生成物脱离反应体系.
(3)工业合成氨的反应为N2(g)+3H2(g)高温、高压催化剂
2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数为$\frac{4}{7}$.
①该条件下N2的平衡转化率为66.7%
②该条件下反应2NH3(g)高温、高压催化剂N2(g)+3H2(g)的平衡常数为0.005.
| 操作和现象 | 结论 | |
| A | 取某溶液少许,加入酸化的Ba(NO3)2溶液,产生白色沉淀 | 该溶液一定含SO42- |
| B | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 结合H+的能力:CO32-<AlO2- |
| C | 某溶液加入盐酸产生使石灰水变浑浊的无色无味气体 | 该溶液肯定含HCO3-、CO32-中的一种或二种 |
| D | 测定等浓度的Na2CO3和Na2SO3溶液的pH;前者pH比后者的大; | 非金属性:S>C |
| A. | A | B. | B | C. | C | D. | D |
| A. |  收集氢气 | B. |  分离碘和泥沙 | ||
| C. |  分离水和四氯化碳 | D. |  实验室制取蒸馏水 |
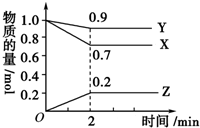 某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为Y+3X?2Z,反应开始至2min,X的转化率为30%.
某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为Y+3X?2Z,反应开始至2min,X的转化率为30%.