题目内容
7.“金属钙线”是炼制优质钢材的脱氧脱磷剂,某“金属钙线”的主要成分为金属Fe和金属钙Ca,并含有3.5%(质量分数)CaO.(1)Ca的原子结构示意图为
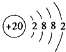 .其最高价氧化物对应水化物的碱性比Mg(OH)2强(填“强”或“弱”).
.其最高价氧化物对应水化物的碱性比Mg(OH)2强(填“强”或“弱”).(2)Ca与非金属性最强的元素A形成化合物D,写出D的电子式
 .
.(3)配平用“金属钙线”脱氧脱磷的方程式:
2P+5FeO+3Cao$\frac{\underline{\;高温\;}}{\;}$1Ca3(PO4)2+5Fe
(4)将“金属钙线”溶于稀盐酸后,再滴加双氧水发生的离子方程式是2Fe2++H2O2+2H+═2Fe3++2H2O.
(5)取3.2g“金属钙线”试样,与水充分反应生成448mL H2(标准状况),在所得溶液中通入适量CO2,最多能得到CaCO32.2g(取两位有效数字).
分析 (1)Ca的原子序数为20,结合原子核外电子排布画出原子结构示意图,金属性越强,对应的最高价氧化物水化物碱性越强;
(2)最活泼的非金属元素为F,再确定该化合物的化学式,根据电子式书写规则写出电子式;
(3)根据得失电子数相等配平方程式;
(4)Fe和稀盐酸反应生成氯化亚铁,亚铁离子不稳定,能被双氧水氧化生成铁离子,双氧水被还原生成水;
(5)钙与水反应生成氢氧化钙与氢气,根据n=$\frac{V}{{V}_{m}}$计算氢气的物质的量,根据电子转移守恒计算Ca的物质的量,根据氧化钙的质量分数计算氧化钙的质量,计算氧化钙的物质的量,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,根据钙元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO),再根据m=nM计算碳酸钙的质量.
解答 解:(1)Ca是20号元素,元素的原子序数=其核外电子数=核内质子数,其核外电子排布是2,8,8,2,所以其原子结构示意图为 ,金属性Ca>Mg,则Ca(OH)2碱性比Mg(OH)2强,故答案为
,金属性Ca>Mg,则Ca(OH)2碱性比Mg(OH)2强,故答案为 ;强;
;强;
(2)元素周期表中最活泼的非金属元素是F元素,与Ca形成化合物离子化合物D,所以D是CaF2,其电子式为 ,
,
故答案为: ;
;
(3)该方程式中元素的化合价变化为:P→Ca3(PO4)2,磷元素由0价→+5价,一个磷原子失5个电子;FeO→Fe,铁元素由+2价→0价,一个 FeO得2个电子,根据氧化还原反应中得失电子数相等,所以其最小公倍数为10,故 P的计量数为2,FeO的计量数为5,其它元素根据原子守恒配平,所以该方程式为2 P+5FeO+3CaO$\frac{\underline{\;高温\;}}{\;}$Ca3(PO4)2+5Fe,
故答案为:2;5;3;1;5Fe;
(4)金属钙线中含铁,Fe和稀盐酸反应生成氯化亚铁,亚铁离子不稳定,能被双氧水氧化生成铁离子,双氧水被还原生成水,离子方程式为2Fe2++H2O2+2H+═2Fe3++2 H2O,故答案为:2Fe2++H2O2+2H+═2Fe3++2 H2O;
(5)448mlH2的物质的量为$\frac{0.448L}{22.4L/mol}$=0.02mol,钙与水反应生成氢氧化钙与氢气,根据电子转移守恒可知,Ca的物质的量为$\frac{0.02mol×2}{2}$=0.02mol,样品中CaO质量分数为3.5%,故氧化钙的质量为3.2g×3.5%=0.112g,故氧化钙的物质的量为$\frac{0.112g}{56g/mol}$=0.002mol,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,根据钙元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO)=0.02mol+0.002mol=0.022mol,碳酸钙的质量为0.022mol×100g/mol=2.2g,
故答案为:2.2.
点评 本题考查金属及化合物的性质及综合应用,为高频考点,把握原子结构与性质,物质的性质及氧化还原反应等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

| A. | 将饱和FeCl3溶液逐滴滴加到NaOH溶液中,即可制得Fe(OH)3胶体 | |
| B. | FeCl3溶液是电中性的,Fe(OH)3胶体是带正电荷的 | |
| C. | 可利用丁达尔现象区别FeCl3溶液和Fe(OH)3胶体 | |
| D. | 将500mL 2mol/L FeCl3溶液制成胶体,胶粒的数目为NA |
| A. | 糖原与纤维素互为同分异构体,与淀粉互为同系物 | |
| B. | 糖原能溶于水,有甜味 | |
| C. | 糖原水解的最终产物是葡萄糖 | |
| D. | 糖原具有还原性,是还原性糖 |
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA | |
| C. | 常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.8NA | |
| D. | 标准状况下,2.24 L已烷含有分子的数目为0.1NA |
| A. | 世博会前期,净化自来水时加入ClO2作为消毒剂 | |
| B. | 世博会期间,利用可降解的“玉米塑料”替代一次性饭盒,可防止产生白色污染 | |
| C. | 世博停车场安装催化光解设施,可将汽车尾气中的CO和NO反应生成无毒气体 | |
| D. | 世博会中国馆一“东方之冠”使用的钢筋混凝土属于高分子化合物 |
| A. | 向某溶液中加入Ba(NO3)2溶液和稀HNO3,有白色沉淀产生,则溶液中一定含有SO42- | |
| B. | 氯气和二氧化硫湿润时均有漂白作用,若将二者等物质的量混合溶于水,漂白效果会增强 | |
| C. | 将稀硫酸滴到淀粉碘化钾试纸上,一段时间后变蓝,有反应4H++4I-+O2=2I2+2H2O发生 | |
| D. | 将足量的CO2逐渐通入含等物质的量的Ba(OH)2和KOH的混合溶液中,生成沉淀的物质的量与CO2的关系如图: |
 ( )
( )| 甲 | 乙 | 丙 | 丁 | |
| A | S | SO2 | SO3 | O2 |
| B | CO32- | HCO3- | CO2 | H+ |
| C | Cl2 | FeCl3 | FeCl2 | Fe |
| D | Al3+ | Al(OH)3 | AlO2- | NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |

| A. | 锌是负极,电子从锌片经导线流向铜片 | |
| B. | 氢离子在铜片表面被还原 | |
| C. | 锌质量减少65g时,铜电极表面析出氢气是22.4L | |
| D. | 装置中存在“化学能→电能→光能”的转换 |