题目内容
【题目】2019年10月1日,我国成功举办国庆七十周年阅兵活动。其中阅兵仪式上混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH= +206.0kJmol-1
(ii)合成甲醇:CO(g)+2H2(g)CH3OH(g) ΔH= -90.67kJmol-1
(1)制备合成气:工业生产中为解决合成气中H2过量而 CO 不足的问题,原料气中需添加CO2,发生的反应(iii):CO2(g)+H2(g) CO(g)+H2O(g) ΔH= +41.17kJmol-1,为了使合成气配比最佳,理论上原料气中二氧化碳与甲烷质量比为 _______。
(2)为节约化石能源、减少碳排放,用CO2代替CO作为制备甲醇的碳源正成为当前研究的焦点。
①请写出二氧化碳加氢合成水蒸气和甲醇的热化学方程式____________。
②研究表明在二氧化碳合成甲醇的原料气的反应中,保持其它条件不变,采用Ⅰ、Ⅱ、Ⅲ三种催化剂,反应进行相同时间后,CO2的转化率随反应体系的温度变化如图所示:

a~d 点中反应一定处于平衡状态的点是____;CO2的转化率 a 点比 c 点高的原因是 ____。
③最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示:
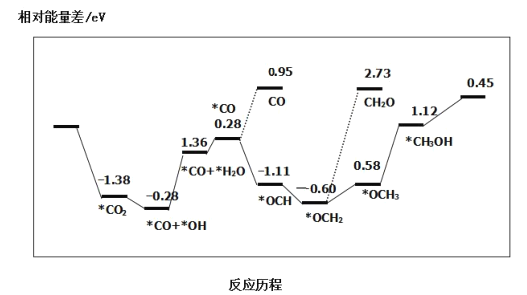
容易得到的副产物有 CO 和CH2O,其中相对较少的副产物为___;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中____(填字母)的能量变化。
A.*CO → *OCH B.*CO+*OH→*CO+*H2O
C.*OCH2→*OCH3D.*OCH3→*CH3OH
(3)在一容积可变的密闭容器中充入10molCO和20molH2合成甲醇,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
①比较A、B 两点压强大小PA_______PB填“>、<、 =”)
②若达到化学平衡状态 A 时,容器的体积为 10 L,如果反应开始时仍充入 10molCO和20molH2,则在平衡状态 B 时,容器的体积V(B)=_______L;
【答案】11:12 CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.5kJ·mol-1 d a、c点反应正向进行,a 点催化效率高,反应快,相同时间内CO2的转化率大 CH2O B < 2
【解析】
(1)设加入的甲烷的物质的量为x,加入二氧化碳的物质的量为y,则![]() ,
,![]() ,由合成甲醇的反应方程式可知,CO和H2物质的量之比=1:2为最佳合成气配比,即(x+y):(3x-y)=1:2,解得x:y=3:1,即原料气中二氧化碳与甲烷质量比=(1×44):(3×16)=44:48=11:12,故答案为:11:12;
,由合成甲醇的反应方程式可知,CO和H2物质的量之比=1:2为最佳合成气配比,即(x+y):(3x-y)=1:2,解得x:y=3:1,即原料气中二氧化碳与甲烷质量比=(1×44):(3×16)=44:48=11:12,故答案为:11:12;
(2)①(ii)CO(g)+2H2(g)CH3OH(g) ΔH2= -90.67kJmol-1
(iii)CO2(g)+H2(g)CO(g)+H2O(g) ΔH3= +41.17kJmol-1
(ii)+(iii)得:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=ΔH2+ΔH3=-49.5kJ·mol-1,故答案为:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-49.5kJ·mol-1;
②该反应的正反应为放热反应;a、b、c三点:反应正向进行,温度升高,反应速率增大,相同时间内二氧化碳的转化率增大,但都没有达到相同温度下的最大转化率,反应没有达到平衡状态;最高点之前,反应正向进行,温度升高,反应速率增大,相同时间内二氧化碳的转化率增大,最高点之后:升高温度,平衡逆向移动,二氧化碳的转化率减小,则d点反应已达平衡。a、c点反应正向进行,温度相同,催化剂不同,催化效率不同,反应速率不同,二氧化碳转化率不同,a点催化效率高,反应快,相同时间的CO2的转化率大,故答案为:d;a、c点反应正向进行,a 点催化效率高,反应快,相同时间内CO2的转化率大;
③得到CO所需活化能=(0.95-0.28)eV=0.67eV,得到CH2O所需活化能=[2.73-(-0.60)]eV=3.33eV,得到CH2O所需活化能高于得到CO所需活化能,所以得到CH2O的速率较慢,相同时间内得到副产物CH2O较少。其它条件相同时,反应所需活化能越高,反应速率越慢,总反应速率主要由较慢的那一步反应决定,即总反应速率由各步反应中所需活化能最大那步决定:
A.*CO → *OCH所需活化能=(-1.11-0.28)eV=-1.39eV;
B.*CO+*OH→*CO+*H2O所需活化能=[1.36-(-0.28)]eV=1.64eV;
C.*OCH2→*OCH3所需活化能=[0.58-(-0.6)]eV=1.18eV;
D.*OCH3→*CH3OH所需活化能=(1.12-0.58)eV=0.54eV;
所以,*CO+*OH→*CO+*H2O活化能最大,决定反应速率,主要降低该变化的能量变化,故答案为:CH2O;B;
(3)①其他条件相同时,增大压强平衡正向移动,CO的转化率增大,根据图像温度相同时,CO的转化率:P2时比P1时大,所以P2>P1,PA<PB,故答案为:<;
②达到平衡状态A,CO的转化率为0.5,则CO反应了0.5×10mol=5mol,列三段式如下: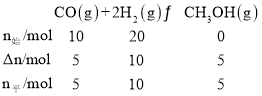 ,体积为10L,则平衡状态A的平衡常数K=
,体积为10L,则平衡状态A的平衡常数K=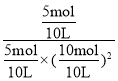 =1L2/mol2。平衡状态B时,CO的转化率为0.8,则CO反应了0.8×10mol=8mol,列三段式如下:
=1L2/mol2。平衡状态B时,CO的转化率为0.8,则CO反应了0.8×10mol=8mol,列三段式如下: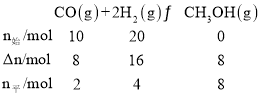 ,平衡状态A和平衡状态B温度相同,则平衡常数K相同,即1L2/mol2=
,平衡状态A和平衡状态B温度相同,则平衡常数K相同,即1L2/mol2=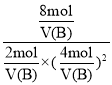 ,解得:V(B)=2L,故答案为:2。
,解得:V(B)=2L,故答案为:2。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案