题目内容
5.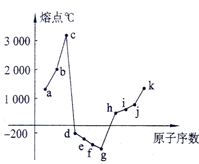 在1-18号元素中,部分连号元素单质的熔点情况如图所示,试回答:
在1-18号元素中,部分连号元素单质的熔点情况如图所示,试回答:(1)c点代表的单质可以是金刚石,其熔点高的主要原因是金刚石是原子晶体.
(2)d所属的晶体类型是分子晶体.
分析 晶体熔沸点大小顺序:原子晶体>金属晶体>分子晶体,
(1)原子晶体熔点最高,原子晶体熔点与键长成反比;
(2)d的熔沸点较低,说明是分子晶体.
解答 解:晶体熔沸点大小顺序:原子晶体>金属晶体>分子晶体,
(1)原子晶体熔点最高,原子晶体熔点与键长成反比,根据图知,c的熔点最高,为原子晶体,短周期元素中,C和Si都是原子晶体,但C-C键长小于Si-Si键,所以碳单质的熔沸点最高,故答案为:金刚石;金刚石原子晶体;
(2)熔沸点较低的单质是分子晶体,d的熔沸点较低,说明是分子晶体,故答案为:分子晶体.
点评 本题以晶体类型与熔沸点高低关系为载体考查元素周期律,明确常见物质晶体类型及熔沸点高低顺序是解本题关键,题目难度不大.

练习册系列答案
 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
20.苹果酸的结构简式为 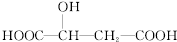 ,下列说法正确的是( )
,下列说法正确的是( )
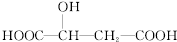 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 1mol苹果酸可与3 mol NaOH发生中和反应 | |
| B. | 1mol苹果酸与足量金属Na反应生成1mol H2 | |
| C. | 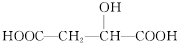 与苹果酸互为同分异构体 与苹果酸互为同分异构体 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
10.下列有关化学用语的表示正确的是( )
| A. | 聚2-甲基-1,3-丁二烯的结构简式: | B. | 间羟基苯甲酸的结构简式: | ||
| C. | N3-的结构示意图: | D. | 氯化钡的电子式: |
17.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且有些可以再生.下列属于最有希望的新能源的是( )
①天然气 ②煤 ③核能 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢能.
①天然气 ②煤 ③核能 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢能.
| A. | ①②③④ | B. | ②⑤⑥⑦ | C. | ①③④⑤⑥ | D. | 除①②外 |
14.下列说法正确的是( )
| A. | 所有放热反应均是自发反应,也是熵增大的反应 | |
| B. | 向AgCl固液混合物中滴入KI饱和溶液,有AgI沉淀生成,说明AgCl的溶解度小于有AgI的溶解度 | |
| C. | 锌与稀硫酸反应制取氢气,加入少量的硫酸铜粉末会使产生氢气的速度减慢 | |
| D. | 用电解法精炼粗铜时,粗铜板作阳极,纯铜板作阴极 |
 ,(2)H2O2:
,(2)H2O2: ,
, ,(4)CO2:
,(4)CO2: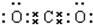 .
.
 ,它可能的结构数目是( )
,它可能的结构数目是( )