题目内容
16.下列电离方程式书写正确的是( )| A. | K2SO4→K++2SO42- | B. | Ba(OH)2→Ba2++2(OH)2- | ||
| C. | CH3COONa→Na++CH3COO- | D. | CH3COOH→H++CH3COO- |
分析 强电解质完全电离,用等号,弱电解质部分电离,用可逆号,原子团不能拆.据此解答.
解答 解:A.硫酸钾为强电解质,完全电离,电离方程式:K2SO4=2K++SO42-,故A错误;
B.氢氧化钡为强电解质,完全电离,电离方程式:Ba(OH)2=Ba2++2OH-,故B错误;
C.醋酸钠为强电解质,完全电离,电离方程式:CH3COONa=Na++CH3COO-,故C正确;
D.醋酸为弱电解质,部分电离,电离方程式:CH3COOH$\stackrel{.}{?}$H++CH3COO-,故D错误;
故选:C.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,题目难度不大.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
6.铅蓄电池的电极材料是Pb和PbO2,电解液是硫酸溶液.现用铅蓄电池电解饱和硫酸钠溶液一段时间.已知蓄电池放电时发生的反应为PbO2+Pb+2H2SO4═2PbSO4+2H2O,假设电解时温度不变且用惰性电极,下列说法不正确的是( )
| A. | 电解后,c(Na2SO4)不变,且溶液中有晶体析出 | |
| B. | 电解池的阳极反应式为:4OH--4e-═2H2O+O2↑ | |
| C. | 蓄电池放电时,每消耗0.1molPb,共生成0.1molPbSO4 | |
| D. | 蓄电池中每生成2molH2O,电解池中就消耗1molH2O |
4.下列各反应中,属于原电池反应的是( )
| A. | 氧化铝膜别破坏后,金属铝被迅速氧化 | |
| B. | 白铁镀锌层破坏后,还能阻止铁被氧化 | |
| C. | 红热的铁与水接触表面上形成蓝黑色的保护层 | |
| D. | 铁与稀硫酸反应时,加入少量CuSO4溶液可使反应加快 |
11.下列各图象中指定时刻(t1)或指定温度(T1)时,表示可逆反应以达到平衡的是( )
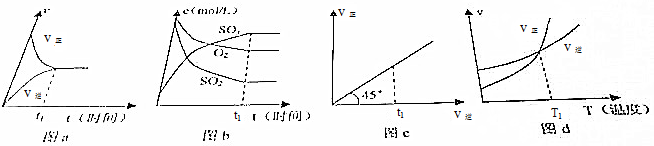

| A. | 只有图a和图b | B. | 只有图a和图d | ||
| C. | 只有图a、图b和图d | D. | 图a、图b、图c和图d都是 |
1.在常温、常压下能够大量共存,并能用浓硫酸干燥的一组气体是( )
| A. | NH3、HCl、O2 | B. | O2、CO2、NO | C. | O2、H2、SO2 | D. | N2、H2、NH3 |
4.下列相关反应 的离子方程式或化学方程式书写正确的是( )
| A. | CuSO4溶液呈酸性的原因:Cu2++2H2O═Cu(OH)2↓+2H+ | |
| B. | 向NH4HCO3溶液中加过量石灰水并加热:${NH}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | Fe(OH)2溶于氨碘酸中:Fe(OH)3+3H+═Fe3++3H2O | |
| D. | 氧化亚铜和稀硫酸反应:Cu2O+H2SO4═CuSO4+Cu+H2O |
1.下列关于图中钠及其化合物转化的叙述中,不正确的是( )
| A. | ①为离子反应 | B. | ②为置换反应 | C. | ③是化合反应 | D. | ④可能为离子反应 |