题目内容
4.下列各反应中,属于原电池反应的是( )| A. | 氧化铝膜别破坏后,金属铝被迅速氧化 | |
| B. | 白铁镀锌层破坏后,还能阻止铁被氧化 | |
| C. | 红热的铁与水接触表面上形成蓝黑色的保护层 | |
| D. | 铁与稀硫酸反应时,加入少量CuSO4溶液可使反应加快 |
分析 A、Al为活泼金属易被空气中的氧气氧化;
B、铁、锌和电解质溶液符合原电池构成条件,则形成原电池,锌易失电子作负极,铁作正极;
C、红热的铁丝和水直接反应生成黑色的四氧化三铁和氢气,不符合原电池构成条件,属于化学腐蚀;
D、铁置换出铜,铁、铜和稀硫酸构成原电池,进而加快反应速率.
解答 解:A、在空气中铝表面迅速氧化形成保护层是因Al被氧化为氧化铝,与电化学无关,故A错误;
B、铁、锌和电解质溶液符合原电池构成条件,则形成原电池,锌易失电子作负极,铁作正极,正极金属被保护,所以发生原电池反应,故B正确;
C、红热的铁丝和水直接反应生成黑色的四氧化三铁和氢气,不符合原电池构成条件,属于化学腐蚀,故C错误;
D、铁置换出铜,铁、铜和稀硫酸构成原电池,进而加快反应速率,与电化学有关,故D正确;
故选BD.
点评 本题考查了化学腐蚀和电化学腐蚀的判断,根据原电池构成条件来分析解答即可,难度不大.

练习册系列答案
相关题目
12.氯水中有Cl2、HCl、HClO,其中含量最多的是( )
| A. | HCl | B. | HClO | C. | Cl2 | D. | 不能确定 |
16.下列电离方程式书写正确的是( )
| A. | K2SO4→K++2SO42- | B. | Ba(OH)2→Ba2++2(OH)2- | ||
| C. | CH3COONa→Na++CH3COO- | D. | CH3COOH→H++CH3COO- |
10.下列离子方程式正确的是( )
| A. | 氯气通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 过量的氯气通入溴化亚铁溶液中:3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2 | |
| C. | 次氯酸钠溶液中加入少量硫酸亚铁溶液:Fe2++2ClO-+H2O=Fe(OH)2↓+2HClO | |
| D. | NaHCO3溶液与过量Ba(OH)2溶液混合:2HCO3-+2OH-+Ba2+=BaCO3↓+CO32-+2H2O |
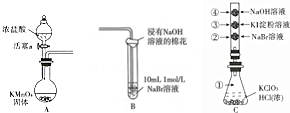
 ,浸有氢氧化钠溶液的棉花的作用是吸收多余的氯气,防止污染环境
,浸有氢氧化钠溶液的棉花的作用是吸收多余的氯气,防止污染环境