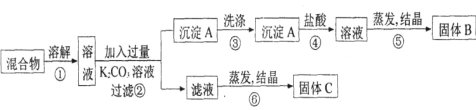
题目内容
【题目】二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁熔点是173 ℃(在100 ℃时开始升华),沸点是249 ℃,不溶于水,易溶于苯、乙醚等非极性溶剂。下列说法不正确的是( )
A. 二茂铁属于分子晶体
B. 在二茂铁结构中,C5H![]() 与Fe2+之间形成的化学键类型是离子键
与Fe2+之间形成的化学键类型是离子键
C. 已知:环戊二烯的结构式为: ,则其中仅有1个碳原子采取sp3杂化
,则其中仅有1个碳原子采取sp3杂化
D. C5H![]() 中一定含π键
中一定含π键
【答案】B
【解析】试题分析:A、根据二茂铁的物理性质,熔点低,易升华,易溶于有机溶剂,说明二茂铁为分子晶体,故说法正确;B、碳原子含有孤电子对,铁原子含有空轨道,两者形成配位键,故说法错误;C、1号碳原子含有4个σ键无孤电子对,杂化类型为sp3,2、3、4、5碳原子有3个σ键无孤电子对,杂化类型为sp2,因此仅有1个碳原子采取sp3杂化,故说法正确;D、C5H5-中,碳原子没有达到饱和,存在碳碳双键,成键原子间只能形成一个σ键,另一个键必然形成π键,故说法正确。

【题目】关于强弱电解质及非电解质的组合完全正确的是( )
A | B | C | D | |
强电解质 | NaCl | H2SO4 | NaOH | HNO3 |
弱电解质 | HF | BaSO4 | CaCO3 | CH3COOH |
非电解质 | Cl2 | CO2 | C2H5OH | SO2 |
A. A B. B C. C D. D
【题目】短周期元素 W、X、Y、Z 在元素周期表中的位置如图所示。其中 Z 的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
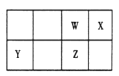
(1)W 在元素周期表中的位置是____________。
(2)W、X、氢元素形成的三原子分子的电子式____________。
(3)下列选项中,能证明元素非金属性X强于W的是____________。
A.相对原子质量:X>W | B.最低化合价:X>W |
C.最简单氢化物的稳定性:X>W | D.最高价氧化物的水化物酸性:X>W |
(4)元素周期表中与 Z 同周期的某金属元素形成的单质 A,可发生如下图所示的转化:
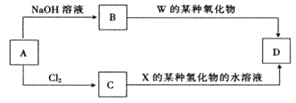
其中化合物D是一种白色沉淀,则 B 中溶质的化学式为____________;
B与 C也可直接转化生成 D 写出对应的离子方程式为____________。