题目内容
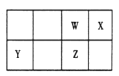
【题目】短周期元素 W、X、Y、Z 在元素周期表中的位置如图所示。其中 Z 的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
(1)W 在元素周期表中的位置是____________。
(2)W、X、氢元素形成的三原子分子的电子式____________。
(3)下列选项中,能证明元素非金属性X强于W的是____________。
A.相对原子质量:X>W | B.最低化合价:X>W |
C.最简单氢化物的稳定性:X>W | D.最高价氧化物的水化物酸性:X>W |
(4)元素周期表中与 Z 同周期的某金属元素形成的单质 A,可发生如下图所示的转化:
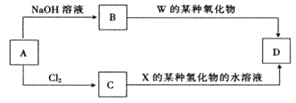
其中化合物D是一种白色沉淀,则 B 中溶质的化学式为____________;
B与 C也可直接转化生成 D 写出对应的离子方程式为____________。
【答案】(1)第二周期第IVA族
(2)![]()
(3)CD
(4)NaAlO2; Al3++3AlO2-+6H2O=Al(OH) 3↓
【解析】试题分析:短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中Z的单质是一种重要半导体材料,广泛应用于电子工业的各个领域,则Z是硅,因此W是C,X是N,Y是Mg。
(1)碳元素的原子序数是6,在元素周期表中的位置是第二周期第ⅣA族 。
(2)C、N、H元素形成的三原子分子是HCN,电子式![]()
(3)A.非金属性强弱与原子序数没有关系,A错误;B.非金属性强弱与最低化合价没有关系,B错误;C.非金属性越强,氢化物的稳定性越强,则最简单氢化物的稳定性:X>W可以说明元素非金属性X强于W,C正确;D.非金属性越强,最高价氧化物对应水化物的酸性越强,则最高价氧化物的水化物酸性:X>W可以说明元素非金属性X强于W,D正确,答案选CD。
(4)金属元素形成的单质A能与氢氧化钠溶液反应生成B,也能与氯气反应生成C,C与氨气反应生成D,化合物D是一种白色沉淀,这说明A是铝,B是偏铝酸钠,C是氯化铝,D是氢氧化铝,则B中溶质的化学式为NaAlO2,偏铝酸钠能与CO2反应生成氢氧化铝沉淀。氯化铝与偏铝酸钠直接转化生成氢氧化铝,对应的离子方程式为Al3++3AlO2-+6H2O=Al(OH) 3↓。

 名校课堂系列答案
名校课堂系列答案【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
2min末浓度/(mol·L-1) | 0.08 | a | b |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是
A.平衡时,X的转化率为20%
B.2min时Y的物质的量为0.14
C.增大平衡后的体系压强,v(正)增大,v(逆)减小
D.2min内,用Y的变化量表示的平均反应速率v(Y)=0.03mol·L―1·min―1