题目内容
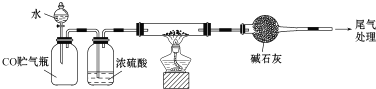
【题目】实验室以铝铁质岩![]() 主要成分是
主要成分是![]() 、
、![]() 和
和![]() 为原料制备
为原料制备![]() 和粗硅,其流程如图所示:
和粗硅,其流程如图所示:
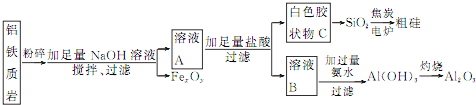
![]() 制备粗硅的化学方程式为 ______ 。
制备粗硅的化学方程式为 ______ 。
![]() 溶液B中加氨水生成
溶液B中加氨水生成![]() 的离子方程式为 ______,在空气中灼烧固体
的离子方程式为 ______,在空气中灼烧固体![]() 时,用到多种硅酸盐质仪器,除玻璃棒、酒精灯、泥三角外,还有 ______
时,用到多种硅酸盐质仪器,除玻璃棒、酒精灯、泥三角外,还有 ______ ![]() 填仪器名称
填仪器名称![]() 。
。
![]() 在高温下,氧化铝可以与氮气、碳反应,生成一种耐高温、抗冲击的氮化铝和一种有毒气体,该反应的化学方程式为 ______ ;该反应中每生成2mol氮化铝,
在高温下,氧化铝可以与氮气、碳反应,生成一种耐高温、抗冲击的氮化铝和一种有毒气体,该反应的化学方程式为 ______ ;该反应中每生成2mol氮化铝,![]() 得到电子的物质的量为 ______ mol。
得到电子的物质的量为 ______ mol。
![]() 某实验小组用CO还原法定量测定
某实验小组用CO还原法定量测定![]() 的组成,称取mg样品进行定量测定。
的组成,称取mg样品进行定量测定。
![]() 根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品, ______
根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品, ______ ![]() 请按正确顺序填入下列步骤的标号
请按正确顺序填入下列步骤的标号![]() 。
。
![]() 点燃酒精灯
点燃酒精灯![]() 打开分液漏斗活塞
打开分液漏斗活塞![]() 停止加热,充分冷却
停止加热,充分冷却 ![]() 关闭分液漏斗活塞
关闭分液漏斗活塞![]() 收集气体并检验纯度
收集气体并检验纯度
![]() 若实验中每步反应都进行完全,反应后样品质量减少了ng,则
若实验中每步反应都进行完全,反应后样品质量减少了ng,则![]() 中x:
中x:![]() ______
______ ![]() 若实验中
若实验中![]() 未被充分还原,则x:y的值 ______
未被充分还原,则x:y的值 ______ ![]() 填“偏大”“偏小”或“无影响”
填“偏大”“偏小”或“无影响”![]() 。
。
【答案】
![]() 坩埚
坩埚  6 b、e、a、c、d
6 b、e、a、c、d ![]() 偏大
偏大
【解析】
铝铁质岩![]() 主要成分是
主要成分是![]() 、
、![]() 和
和![]() 加入足量的氢氧化钠,氧化铝和二氧化硅溶解,过滤得铁的氧化物,溶液A为硅酸钠和偏铝酸钠溶液,溶液A中加足量的盐酸,生成硅酸沉淀和氯化铝溶液,所以C为硅酸,B为氯化铝,在氯化铝溶液中加入氨水得氢氧化铝沉淀,灼烧得氧化铝,硅酸加热分解得二氧化硅,二氧化硅与碳在高温下发生氧化还原反应生成粗硅,
加入足量的氢氧化钠,氧化铝和二氧化硅溶解,过滤得铁的氧化物,溶液A为硅酸钠和偏铝酸钠溶液,溶液A中加足量的盐酸,生成硅酸沉淀和氯化铝溶液,所以C为硅酸,B为氯化铝,在氯化铝溶液中加入氨水得氢氧化铝沉淀,灼烧得氧化铝,硅酸加热分解得二氧化硅,二氧化硅与碳在高温下发生氧化还原反应生成粗硅,
![]() 与碳在高温条件下反应生成粗硅和一氧化碳;
与碳在高温条件下反应生成粗硅和一氧化碳;
![]() 氯化铝溶液中加入氨水生成氢氧化铝,根据电荷守恒可写出离子反应方程式;固体灼烧一般在坩埚中进行;
氯化铝溶液中加入氨水生成氢氧化铝,根据电荷守恒可写出离子反应方程式;固体灼烧一般在坩埚中进行;
![]() 在高温下,氧化铝可以与氮气、碳反应,生成氮化铝和一种有毒气体,该有毒气体为CO,根据元素守恒书写化学方程式,并根据方程式可计算出电子转移的物质的量;
在高温下,氧化铝可以与氮气、碳反应,生成氮化铝和一种有毒气体,该有毒气体为CO,根据元素守恒书写化学方程式,并根据方程式可计算出电子转移的物质的量;
![]() 实验过程依据反应原理和实验目的分析实验步骤为,组装装置,检验装置气密性,加入试剂,加入水把一氧化碳赶入后续装置,并检验CO的纯度,再点燃酒精灯加热玻璃管,反应结束后停止加热,关闭分液漏斗活塞,玻璃管称量剩余固体,依据质量变化计算铁元素和氧元素物质的量之比;
实验过程依据反应原理和实验目的分析实验步骤为,组装装置,检验装置气密性,加入试剂,加入水把一氧化碳赶入后续装置,并检验CO的纯度,再点燃酒精灯加热玻璃管,反应结束后停止加热,关闭分液漏斗活塞,玻璃管称量剩余固体,依据质量变化计算铁元素和氧元素物质的量之比;
![]() 依据实验结果得到,铁的氧化物中减少的质量为氧元素的质量为ng,铁的质量为(m-n)g,依据元素物质的量计算得到比值,若实验中
依据实验结果得到,铁的氧化物中减少的质量为氧元素的质量为ng,铁的质量为(m-n)g,依据元素物质的量计算得到比值,若实验中![]() 未被充分还原,则n值会偏小,据此分析;
未被充分还原,则n值会偏小,据此分析;
铝铁质岩![]() 主要成分是
主要成分是![]() 、
、![]() 和
和![]() 加入足量的氢氧化钠,氧化铝和二氧化硅溶解,过滤得铁的氧化物,溶液A为硅酸钠和偏铝酸钠溶液,溶液A中加足量的盐酸,生成硅酸沉淀和氯化铝溶液,所以C为硅酸,B为氯化铝,在氯化铝溶液中加入氨水得氢氧化铝沉淀,灼烧得氧化铝,硅酸加热分解得二氧化硅,二氧化硅与碳在高温下发生氧化还原反应生成粗硅。
加入足量的氢氧化钠,氧化铝和二氧化硅溶解,过滤得铁的氧化物,溶液A为硅酸钠和偏铝酸钠溶液,溶液A中加足量的盐酸,生成硅酸沉淀和氯化铝溶液,所以C为硅酸,B为氯化铝,在氯化铝溶液中加入氨水得氢氧化铝沉淀,灼烧得氧化铝,硅酸加热分解得二氧化硅,二氧化硅与碳在高温下发生氧化还原反应生成粗硅。
![]() 与碳在高温条件下反应生成粗硅和一氧化碳,反应的方程式为SiO2+2C
与碳在高温条件下反应生成粗硅和一氧化碳,反应的方程式为SiO2+2C![]() Si+2CO↑,
Si+2CO↑,
故答案为:SiO2+2C![]() Si+2CO↑;
Si+2CO↑;
![]() 氯化铝溶液中加入氨水生成氢氧化铝,反应的离子方程式为
氯化铝溶液中加入氨水生成氢氧化铝,反应的离子方程式为![]() ,固体灼烧一般在坩埚中进行,
,固体灼烧一般在坩埚中进行,
故答案为:![]() ;坩埚;
;坩埚;
![]() 在高温下,氧化铝可以与氮气、碳反应,生成氮化铝和一种有毒气体,该有毒气体为CO,反应化学方程式为Al2O3+N2+3C
在高温下,氧化铝可以与氮气、碳反应,生成氮化铝和一种有毒气体,该有毒气体为CO,反应化学方程式为Al2O3+N2+3C![]() 2AlN+3CO,根据方程式可知,反应中转移电子数为
2AlN+3CO,根据方程式可知,反应中转移电子数为![]() ,所以每生成2mol氮化铝,
,所以每生成2mol氮化铝,![]() 得到电子的物质的量为6mol,
得到电子的物质的量为6mol,
故答案为:Al2O3+N2+3C![]() 2AlN+3CO;6;
2AlN+3CO;6;
![]() 实验过程依据反应原理和实验目的分析实验步骤为,组装装置,检验装置气密性,加入试剂,加入水把一氧化碳赶入后续装置,并检验CO的纯度,再点燃酒精灯加热玻璃管,反应结束后停止加热,关闭分液漏斗活塞,玻璃管称量剩余固体,依据质量变化计算铁元素和氧元素物质的量之比,所以操作顺序为b、e、a、c、d,
实验过程依据反应原理和实验目的分析实验步骤为,组装装置,检验装置气密性,加入试剂,加入水把一氧化碳赶入后续装置,并检验CO的纯度,再点燃酒精灯加热玻璃管,反应结束后停止加热,关闭分液漏斗活塞,玻璃管称量剩余固体,依据质量变化计算铁元素和氧元素物质的量之比,所以操作顺序为b、e、a、c、d,
故答案为:b、e、a、c、d;
![]() 依据实验结果得到,铁的氧化物中减少的质量为氧元素的质量为ng,铁的质量为(m-n)g,依据元素物质的量计算得到比值,x:
依据实验结果得到,铁的氧化物中减少的质量为氧元素的质量为ng,铁的质量为(m-n)g,依据元素物质的量计算得到比值,x:![]() :
:![]() :
:![]() ,若实验中
,若实验中![]() 未被充分还原,则n值会偏小,所以x:y的值会偏大,
未被充分还原,则n值会偏小,所以x:y的值会偏大,
故答案为:![]() ;偏大。
;偏大。

【题目】4Na2SO42H2O2NaCl又称固体双氧水,具有漂白、杀菌、消毒作用,又由于其稳定性比过碳酸钠(2Na2CO33H2O2)固体更好,因而具有广泛的应用前景。某小组合成该固体双氧水的实验步骤和装置示意图如下:

Ⅰ.合成:往三颈瓶中加入56.8g硫酸钠和5.85gNaCl的固体混合物,开启搅拌器;将稍过量的(约70mL)30%H2O2溶液在20~30min内逐滴分批加入。并控制反应温度15~35℃,加完料后持续搅拌15min,反应结束后过滤,低温干燥得到产品。
Ⅱ.产品稳定性取Ⅰ中所得产品置于干燥器内保存一个月,并分别在放置前、放置后取一定质量的样品溶于水,加适量稀硫酸酸化,用0.1000mol/L酸性高锰酸钾滴定,测定产品中双氧水的含量,以此分析产品的稳定性.所得实验数据如下表:
数据 时间 | 样品取用数量(g) | 平均V(KMnO4)/mL |
放置前测定 | a | 25.00 |
放置一个月后测定 | a | 24.90 |
已知:a.H2O2不稳定,加热,加入某些金属离子或加碱均有利于其分解
b.产品稳定性=![]() ×100%
×100%
请回答下列问题:
(1)装置图里方框中应添加仪器a,其名称为_______________________;写出合成4Na2SO42H2O2NaCl的化学方程式:_____________________________。
(2)该合成反应过程中,关键是控制温度,其合理的措施是:______________。
A.逐滴滴加H2O2 B.选用Na2SO4和NaCl固体,而不用其饱和溶液
C.不断搅拌 D.冰水浴
(3)该合成反应过程中30%的H2O2溶液不应大大过量的原因________________。
(4)4Na2SO42H2O2NaCl固体比过碳酸钠(2Na2CO33H2O2)固体更稳定的可能原因是__________。
(5)产品分析实验时,高锰酸钾溶液装于滴定管中,当滴定到达终点时的现象是_________________。下列关于该滴定实验过程中的仪器选择和操作都正确的是_____________
A. B.
B. C.
C. D.
D.
(6)该产品的“产品稳定性”=___________________。