题目内容
【题目】已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH = - 49.0 kJmol-1。向3个恒容的密闭容器中分别投入物质的量比为 3∶4 的CO2和H2,H2的物质的量(mol)随时间(min)变化如下表(T表示温度),下列说法正确的是
CH3OH(g)+H2O(g) ΔH = - 49.0 kJmol-1。向3个恒容的密闭容器中分别投入物质的量比为 3∶4 的CO2和H2,H2的物质的量(mol)随时间(min)变化如下表(T表示温度),下列说法正确的是
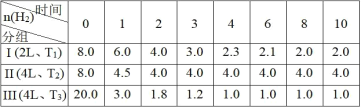
A.在第I组在0~8 min内CO2的平均反应速率为2 mol·L-1·min-1,且放出98 kJ热量
B.第I组第10 min后,恒温,再充入1 mol CO2(g)和3 mol H2O(g),则v 正<v 逆
C.3 min时,保持T2,若对第II组加压使体积缩小2 L,重新达平衡后各组分浓度与第I组相同
D.对比第I和第III组,在 0~4 min内,能说明H2的平均反应速率随温度升高而增大
【答案】B
【解析】
A.根据表格数据可知:在第I组在0~8 min内H2的物质的量改变6.0 mol,则CO2的物质的量变化2.0 mol,CO2平均反应速率v(CO2)=![]() =0.125 mol·L-1·min-1,A错误;
=0.125 mol·L-1·min-1,A错误;
B. 第I组第10 min后,恒温,再充入1 mol CO2(g)和3 mol H2O(g),由于生成物H2O(g)浓度增大的多于反应物CO2(g)浓度的增大,则反应速率v 正<v 逆,B正确;
C. 由于该反应的正反应是气体体积减小的反应,增大压强,化学平衡正向移动,3 min时,保持T2,若对第II组加压使体积缩小2 L,体系的压强增大,尽管物质的量及容器的容积与第I组相同,但由于温度T1、T2温度不同,所以最终重新达平衡后各组分浓度与第I组不相同,C错误;
D. 第I和第III组的物质浓度与反应温度都不相同,因此不能说明H2的平均反应速率随温度升高而增大,D错误;
故合理选项是B。

练习册系列答案
相关题目