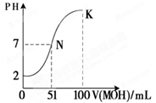
题目内容
下列叙述正确的是
| A.95 ℃纯水的pH<7,说明加热可导致水呈酸性 |
| B.pH=3的醋酸溶液,稀释至10倍后pH=4 |
| C.0.2 mol·L-1的盐酸,与等体积水混合后pH=1 |
| D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
C
试题分析:A、水是弱电解质,电离吸热,加热促进电离,所以95 ℃纯水的pH<7。但任何纯水都是显中性的,A不正确;B、醋酸是弱酸,存在电离平衡。稀释促进电离,氢离子的物质的量增加,所以pH=3的醋酸溶液,稀释至10倍后3<pH<4,B不正确;C、0.2 mol·L-1的盐酸,与等体积水混合后溶液的浓度=0.1mol/L,所以溶液的pH=1,C正确;D、醋酸是弱酸,则pH=3的醋酸溶液中醋酸的浓度大于10-3mol/L。而pH=11的氢氧化钠溶液中氢氧化钠的浓度=10-3mol/L,所以二者等体积混合后醋酸过量,溶液显酸性,即pH<7,D不正确,答案选C。

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
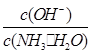 ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。