题目内容
用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列操作会引起测定结果偏高的是:(1)滴定时,装待测溶液的锥形瓶有少量水;(2)酸式滴定管用蒸馏水洗后,未用标准溶液洗;(3)滴定终点读数时,仰视刻度线 ( )
| A.只有(1) | B.只有(2) | C.(2)(3) | D.(1)(2)(3) |
C
试题分析:酸碱滴定时,n(H+)=n(OH-).对于盐酸与氢氧化钠溶液来说C酸·V酸=C碱·V碱。所以C碱="(" C酸·V酸)÷V碱。(1)滴定时,装待测溶液的锥形瓶有少量水.由于没有改变酸、碱的物质的量,所以对所配的溶液的浓度无影响,错误。(2)酸式滴定管用蒸馏水洗后,如果未用标准溶液洗,则标准溶液的浓度偏小,以此为标准消耗的酸溶液的体积就偏大。分子偏大,所以计算出的碱的浓度就偏大。正确。(3)滴定终点读数时,仰视刻度线,则标准酸溶液的体积就偏大。分子偏大,以此为标准计算的碱溶液的浓度就偏大。正确。故符合要求的是(2)(3)。选项为C.

练习册系列答案
相关题目
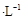 (NH4)2 SO4溶液中逐滴加入0.2000 mol
(NH4)2 SO4溶液中逐滴加入0.2000 mol