题目内容
【题目】锌及其化合物用途广泛。回答下列问题
(1)火法炼锌以闪锌矿(主要成分是ZnS) 为主要原料,涉及的主要反应有:
2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g) △H1=-930kJ·mol-1
C(s)+O2(g)=CO2(g) △H2=-393.5 kJ·mol-1
C(s)+CO2(g)=2CO(g) △H3= +172.5 kJ·mol-1
ZnO(s)+CO(g)=Zn(g)+CO2(g)△H4= +198 kJ·mol-1
反应ZnS(s)+tC(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g)的△H =_________kJ·mol-1
(2)银锌蓄电池工作原理为Ag2O2+2Zn+2H2O![]() 2Ag +2Zn(OH)2,该蓄电池充电时,发生还原反应的物质是__________, 正极反应分为两个阶段,第二阶段为Ag2O+H2O+2e-= 2Ag+2OH-,写 出第一阶 段 正极 电极反应式_____________________________。
2Ag +2Zn(OH)2,该蓄电池充电时,发生还原反应的物质是__________, 正极反应分为两个阶段,第二阶段为Ag2O+H2O+2e-= 2Ag+2OH-,写 出第一阶 段 正极 电极反应式_____________________________。
(3)以(2)中蓄电池作电源,用如图所示的装置在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是__________________(用相关的电极反应式和离子方程式表示)。
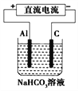
【答案】 -377.5 Zn(OH)2 Ag2O2+H2O+2e-=Ag2O+2OH- Al-3e-=Al3+,Al3++3HCO3-=Al(OH)3↓+3CO2↑或Al-3e-+3HCO3-=Al(OH)3↓+3CO2↑
【解析】(1)①2ZnS(s)+3O2(g)═2ZnO(s)+2SO2(g)△H1=-930kJmol-1,②2C(s)+O2(g)═2CO(g)△H2=-221kJmol-1,③ZnO(s)+CO(g)═Zn(g)+CO2(g)△H3=198kJmol-1,根据盖斯定律,将方程式![]() +③得ZnS(s)+C(s)+2O2(g)═Zn(g)+CO2(g)+SO2(g),△H4=
+③得ZnS(s)+C(s)+2O2(g)═Zn(g)+CO2(g)+SO2(g),△H4=![]() +198kJ/mol=-377.5kJ/mol,故答案为:-377.5;
+198kJ/mol=-377.5kJ/mol,故答案为:-377.5;
(2)银锌蓄电池工作原理为Ag2O2+2Zn+2H2O![]() 2Ag+2Zn(OH)2,该蓄电池充电时,阴极发生还原反应,根据方程式,阴极上发生还原反应的物质为Zn(OH)2;放电时是原电池,正极发生还原反应,反应分为两个阶段,第二阶段为Ag2O+H2O+2e-=2Ag+2OH-,则第一阶段正极的电极反应式为Ag2O2+H2O+2e-=Ag2O+2OH-,故答案为:Zn(OH)2;Ag2O2+H2O+2e-=Ag2O+2OH-;
2Ag+2Zn(OH)2,该蓄电池充电时,阴极发生还原反应,根据方程式,阴极上发生还原反应的物质为Zn(OH)2;放电时是原电池,正极发生还原反应,反应分为两个阶段,第二阶段为Ag2O+H2O+2e-=2Ag+2OH-,则第一阶段正极的电极反应式为Ag2O2+H2O+2e-=Ag2O+2OH-,故答案为:Zn(OH)2;Ag2O2+H2O+2e-=Ag2O+2OH-;
(3)铝作阳极,阳极上电极反应式为Al=Al3++3e-;阳极上生成的铝离子和碳酸氢根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,所以溶液变浑浊Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al=Al3++3e-、Al3++3HCO3-=Al(OH)3↓+3CO2↑。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】请用C、H、O、N、S五种元素回答下列问题
(1)除H外,其它四种元素中,第一电离能最大的元素基态原子电子排布图为______________,电负性最大的元素基态原子核外电子运动状态共有_________种。
(2)五种元素中,由其中两种元素构成甲、乙、丙、丁四种分子,所含原子的数目依次为3、4、6、8,都含有18个电子。甲和乙的主要物理性质比较如下:
熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
甲 | 187 | 202 | 2.6 |
乙 | 272 | 423 | 以任意比互溶 |
①1mol乙分子含有_________个σ键;
②丁分子的中心原子采取_________杂化方式;甲分子的VSEPR模型为_________,丙分子为_________(“极性”或“非极性”)分子。
③甲和乙的相对分子质量基本相同,造成上述物理性质差异的主要原因是:____________________(结合具体物质解释)。
(3)已知
化学键 | N-N | N=N | N | C-C | C=C | C |
键能/kJ·mol-1 | 193 | 418 | 946 | 347.7 | 615 | 812 |
由以上数据可知,氮气比乙烯、乙炔难发生加成反应,原因是____________________。