��Ŀ����
����Ŀ���Ȼ�����һ����Ҫ�Ļ�ѧ�Լ����侧��Ļ�ѧʽΪFeCl3��6H2O��FeCl3�ı�����Һ��ʵ���Һ͵��ӹ�ҵ�ж�����ҪӦ�á�
��1������FeCl3��Һ����ɫ��______________ɫ�ģ�ʵ�����ﳣ�������Ʊ�______________����ѧʽ�����壬������������ǣ��Ƚ��ձ��е�ˮ���������ڣ��ٵ���5~6��____________________��______________��Һ���______________ɫ��ֹͣ���ȡ�
��2�����ӹ�ҵ�� ������FeCl3�ı�����Һ��ӡˢ��·ͼ�壬��Ӧ��ԭ���ǣ�Cu+2FeCl3=2FeCl2+CuCl2���÷�Ӧ��______________�����������õ����ŷ���ʾ����ת�Ƶķ������Ŀ��____________��
��3����0.5mol��L��1��FeCl3��Һ��100mLϡ����500mL��������Һ�У�c(Cl����Ϊ__________����д��������̣�
���𰸡��ػ� Fe(OH)3 FeCl3�ı�����Һ ������� ��� FeCl3  0.3mol��L��1
0.3mol��L��1
��������
��1��������������������Ʊ����̺��������ش�
��2���õ��ӻ��ϼ۽��͵ķ�Ӧ��������������Ӧ��ͭʧȥ2mol���ӣ�2mol�����ӵ�2mol���ӣ��ɴ˻�����������
��3������ϡ�Ͷ��ɽ⣻
��1������FeCl3��Һ����ɫ�ǻ�ɫ�ģ�ʵ�����ﳣ�������Ʊ� Fe(OH)3����ѧʽ�����壬������������ǣ��Ƚ��ձ��е�ˮ���������ڣ��ٵ���5~6��FeCl3�ı�����Һ�����������Һ��ʺ��ɫ��ֹͣ���ȡ�
��2�����ӹ�ҵ�� ������FeCl3�ı�����Һ��ӡˢ��·ͼ�壬��Ӧ��ԭ���ǣ�Cu+2FeCl3=2FeCl2+CuCl2���÷�Ӧ�еõ��ӻ��ϼ۽��͵ķ�Ӧ������������FeCl3�����������õ����ŷ���ʾ����ת�Ƶķ������Ŀ��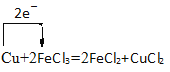 ��
��
��3����0.5mol��L��1��FeCl3��Һ��100mLϡ����500mL��������Һ�У�c(Cl����Ϊ_
c(Cl����=0.5mol��L��1��3��0.1L/0.5L= 0.3mol��L��1��

 �����Ļ�������ҵϵ�д�
�����Ļ�������ҵϵ�д� ����������������ϵ�д�
����������������ϵ�д�