题目内容
【题目】不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。某校研究性学习小组拟设计下列实验验证这一事实。

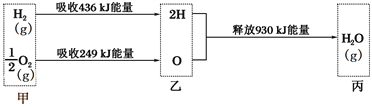
(1)该小组设计了如上图所示的实验装置,检查该装置气密性的操作是______________________。
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重0.64g(烧瓶中残留气体忽略不计,下同),则圆底烧瓶中发生反应的化学方程式为________________________________。
(3)是否使用橡胶管,对实验结果___________(填“有”或“无”) 影响。
【答案】 关闭分液漏斗活塞,向右侧球形管中加入水,一段时间后观察球形管和量气管之间的液面差有无变化(合理即给分) 2Zn+3H2SO4=2ZnSO4+SO2↑+H2↑+2H2O 有
【解析】(1)检验气密性,可关闭分液漏斗活塞,向右侧球形管中加入水,一段时间后观察球形管和量气管之间的液面差有无变化,故答案为:关闭分液漏斗活塞,向右侧球形管中加入水,一段时间后观察球形管和量气管之间的液面差有无变化;
(2)n(Zn)= ![]() =0.02mol,若锌与硫酸只生成二氧化硫气体,则根据Zn+2H2SO4=ZnSO4+SO2↑+2H2O,反应生成的二氧化硫为0.02mol,质量为0.02mol×64g/mol=1.28g,大于氢氧化钠洗气瓶增重0.64 g,说明还生成了氢气且反应生成二氧化硫的锌为0.01mol,生成氢气的锌为0.01mol,则圆底烧瓶中发生反应的化学方程式为2Zn+3H2SO4=2ZnSO4+SO2↑+H2↑+2H2O,故答案为:2Zn+3H2SO4=2ZnSO4+SO2↑+H2↑+2H2O;
=0.02mol,若锌与硫酸只生成二氧化硫气体,则根据Zn+2H2SO4=ZnSO4+SO2↑+2H2O,反应生成的二氧化硫为0.02mol,质量为0.02mol×64g/mol=1.28g,大于氢氧化钠洗气瓶增重0.64 g,说明还生成了氢气且反应生成二氧化硫的锌为0.01mol,生成氢气的锌为0.01mol,则圆底烧瓶中发生反应的化学方程式为2Zn+3H2SO4=2ZnSO4+SO2↑+H2↑+2H2O,故答案为:2Zn+3H2SO4=2ZnSO4+SO2↑+H2↑+2H2O;
(3)使用橡胶管可以平衡气压,保证烧瓶中的压强不变,如果不使用橡胶管,会导致排出的气体体积偏大,对实验结果造成影响,故答案为:有。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】在T℃时,发生反应C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
(1)恒温时,在一个2L的密闭容器中加入4molC 和1molH2O(g),5min后反应达到平衡,C 的转化率为20%。
①0~5min 内,用H2O(g)表示的平均反应速率为_________。
②有关该反应下列说法正确的是_________。
a.容器中压强不变或混合气体密度不变均可以判定该反应已经达到平衡状态
b.若将加入的碳块改为碳粉,则能够提高水蒸气的平衡转化率
c.平衡后,再加入0 .5molC、5mol H2O(g)、2molCO、2molH2,平衡不移动
(2)已知:Ⅰ.破坏1mol 共价键所需要的能量如下表:
共价键 | 石墨中的碳碳键 | H-H | C | H-O |
能量/kJ | 475.7 | 436 | 1072 | 463 |
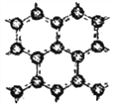
Ⅱ.石墨层由六角形蜂巢结构的碳原子构成,如右图所示,已知每个碳原子形成的共价键数为1.5NA。
某同学构想:通过下图所示装置实现C(s)+H2O(g)![]() CO(g)+H2(g)的反应。
CO(g)+H2(g)的反应。
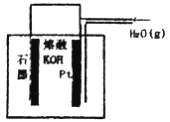
①按该考生的构想,石墨电极发生的反应式为_______________________。
②请用计算判断该构想的合理性:______________________。