题目内容
【题目】电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
化学式 | HF | H2CO3 | HClO |
电离平衡 常数(Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
(1)将浓度为0.1mol·L-1HF溶液加水稀释一倍(假设温度不变),下列各量增大的是___。
A.c(H+) B.c(H+)·c(OH-) C.![]() D.
D.![]()
(2)25℃时,在20mL0.1mol·L-1氢氟酸中加入VmL0.1mol·L-1NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是___。
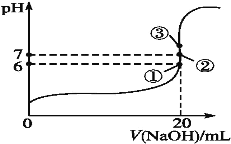
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中c(F-)-c(Na+)=9.9×10-7mol·L-1
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol·L-1
(3)物质的量浓度均为0.1mol·L-1的下列四种溶液:①Na2CO3溶液;②NaHCO3溶液;③NaF溶液;④NaClO溶液。依据数据判断pH由大到小的是___。
(4)Na2CO3溶液显碱性是因为![]() 水解的缘故,请设计简单的实验事实证之___。
水解的缘故,请设计简单的实验事实证之___。
(5)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO其结构式为H-O-F。HFO与水反应得到HF和化合物A,每生成1molHF转移___mol电子。
【答案】CD BC ①④②③(或①>④>②>③) 在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅 1
【解析】
浓度为0.1mol·L-1HF溶液加水稀释一倍,虽然电离程度增大,但c(H+)、c(F-)、c(HF)都减小,c(OH-)增大。25℃时,在20mL0.1mol·L-1氢氟酸中加入VmL0.1mol·L-1NaOH溶液,①点时pH=6,说明HF、NaF混合溶液中以HF电离为主;②点时,pH=7,则表明HF、NaF混合溶液中,HF电离的程度与F-水解的程度相等;③点时V=20mL,溶液中只有NaF一种溶质,则F-水解而使溶液显碱性。在盐溶液中,酸电离常数越大,酸根离子水解的程度越小;若想证明酸根离子发生水解而使溶液显碱性,需证明离子浓度改变后,溶液的性质发生明显的改变;HFO与水反应得到HF和化合物A,依据质量守恒,A应为H2O2。
(1)A.浓度为0.1mol·L-1HF溶液加水稀释一倍,虽然电离程度增大,但c(H+)减小,A不合题意;
B.c(H+)·c(OH-)=KW,温度不变时,水的离子积常数不变,B不合题意;
C.![]() =
=![]() ,加水稀释,K(HF)不变,但c(F-)减小,所以
,加水稀释,K(HF)不变,但c(F-)减小,所以![]() 增大,C符合题意;
增大,C符合题意;
D.HF溶液加水稀释后,c(H+)减小,c(OH-)增大,则![]() 增大,D符合题意;
增大,D符合题意;
故选CD。答案为:CD;
(2)A.pH=3的HF溶液中水的电离受到抑制,pH=11的NaF溶液中,因F-而促进水的电离,所以由水电离出的c(H+)后者大于前者,A不正确;
B.①点时pH=6,HF、NaF混合溶液中以HF电离为主,此时溶液中c(F-)-c(Na+)= c(H+)- c(OH-)=10-6mol/L-10-8mol/L=9.9×10-7mol·L-1,B正确;
C.②点时,依据电荷守恒c(F-)+ c(OH-)=c(Na+)+ c(H+),pH=7,c(H+)=c(OH-),所以溶液中的c(F-)=c(Na+),C正确;
D.③点时V=20mL,溶液中只有NaF一种溶质,则F-水解而使溶液显碱性,此时溶液中c(F-)<c(Na+)=0.05mol·L-1,D不正确;
故选BC。答案为:BC;
(3)物质的量浓度均为0.1mol·L-1的下列四种溶液:①Na2CO3溶液;②NaHCO3溶液;③NaF溶液;④NaClO溶液。电离平衡常数的数据越小,盐的水解能力越强,c(OH-)越大,pH越大,由此确定盐的水解能力:Na2CO3溶液> NaClO溶液> NaHCO3溶液> NaF溶液,pH由大到小的是①④②③(或①>④>②>③)。答案为:①④②③(或①>④>②>③);
(4)Na2CO3溶液显碱性是因为![]() 水解的缘故,可通过减少
水解的缘故,可通过减少![]() 的浓度,观察溶液的颜色发生明显的改变,确定
的浓度,观察溶液的颜色发生明显的改变,确定![]() 水解使溶液显碱性,简单的实验事实为:在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅。答案为:在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅;
水解使溶液显碱性,简单的实验事实为:在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅。答案为:在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅;
(5)在HFO中,O元素显0价,HFO+H2