题目内容
【题目】某学习小组用如图所示装置探究金属锌和稀硫酸的反应,实验过程中电流表的指针发生偏转。请回答下列问题:
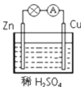
(1)锌片做电池的__________极(填“正或负”),发生的电极反应式:__________。
(2)铜片的现象是__________,发生的电极反应式:__________。
(3)若将稀H2SO4换成CuSO4,则正极反应式为:__________。
(4)若将电极换成铁片和铜片,则负极是__________(填“铁片或铜片”)
【答案】负 Zn-2e-=Zn2+ 有气泡冒出 2H++2e-=H2↑ Cu2++2e-=Cu 铁片
【解析】
两个活动性不同的电极,用导线连接后与电解质溶液接触,电流计指针偏转,则说明有电流产生,从而表明形成原电池。在原电池中,相对活泼的金属电极为负极,相对不活泼的金属电极或石墨电极为正极。在负极,负极材料失电子;在正极,溶液中的阳离子在在电极上得电子。
(1)锌的金属活动性比铜强,所以锌片做电池的负极,锌失电子生成锌离子,发生的电极反应式:Zn-2e-=Zn2+。答案为:负;Zn-2e-=Zn2+;
(2)铜片为正极,溶液中的H+获得电子生成氢气,所以看到的现象是有气泡冒出,发生的电极反应式:2H++2e-=H2↑。答案为:有气泡冒出;2H++2e-=H2↑;
(3)若将稀H2SO4换成CuSO4,则正极为Cu2+获得电子生成Cu,反应式为:Cu2++2e-=Cu。答案为:Cu2++2e-=Cu;
(4)若将电极换成铁片和铜片,则由于铁的金属活动性比铜强,所以负极是铁片。答案为:铁片。

【题目】电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
化学式 | HF | H2CO3 | HClO |
电离平衡 常数(Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
(1)将浓度为0.1mol·L-1HF溶液加水稀释一倍(假设温度不变),下列各量增大的是___。
A.c(H+) B.c(H+)·c(OH-) C.![]() D.
D.![]()
(2)25℃时,在20mL0.1mol·L-1氢氟酸中加入VmL0.1mol·L-1NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是___。
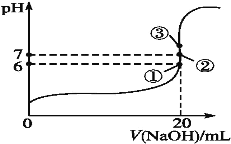
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中c(F-)-c(Na+)=9.9×10-7mol·L-1
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol·L-1
(3)物质的量浓度均为0.1mol·L-1的下列四种溶液:①Na2CO3溶液;②NaHCO3溶液;③NaF溶液;④NaClO溶液。依据数据判断pH由大到小的是___。
(4)Na2CO3溶液显碱性是因为![]() 水解的缘故,请设计简单的实验事实证之___。
水解的缘故,请设计简单的实验事实证之___。
(5)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO其结构式为H-O-F。HFO与水反应得到HF和化合物A,每生成1molHF转移___mol电子。
【题目】Ⅰ.几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1)M在元素周期表中的位置为________________。
(2)X与Y按原子个数比2∶1构成的物质的电子式为________________;所含化学键类型_________。
(3)X+、 Y2-、M2-离子半径大小顺序为_____________________________________。
(4)将YM2通入FeCl3溶液中的离子方程式:______________________________________。
Ⅱ.如下图转化关系:![]()
![]()
![]()
![]()
![]()
(1)若B为白色胶状不溶物,则A与C反应的离子方程式为_______________________。
(2)若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为___________。
【题目】空气中CO2含量偏高会产生温室效应,也会对人体健康造成影响;CO2的用途广泛,合理使用则可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)一定条件下CO2可制得Na2CO3、NaHCO3等。
①等物质的量浓度的Na2CO3、NaHCO3溶液,碱性前者____后者(填“>”“<”或“=”)。
②有下列五种物质的量浓度均为0.1mol/L的电解质溶液,将其稀释相同倍数时,其中pH变化最大的是__(填字母编号)。
A.Na2CO3 |
B.NaHCO3 |
C.NaAlO2 |
D.CH3COONa |
E.NaOH
(2)已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH=a kJ/mol,测得在不同温度下,
FeO(s)+CO(g) ΔH=a kJ/mol,测得在不同温度下,
该反应的平衡常数K随温度的变化如下:
温度(℃) | 300 | 500 | 700 |
K | 3.00 | 3.47 | 4.40 |
上述反应中a_______0(填“>”、“<”或“=”);在2L密闭容器中300℃下进行反应,若Fe和CO2的起始量均为4 mol,当达到平衡时CO2的转化率为________。
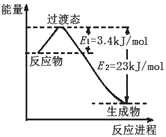
(3)目前工业上可以用CO2和H2在230℃、催化剂条件下反应生成甲醇蒸汽和水蒸气。下图为恒压容器中0.5 mol CO2和1.5 mol H2反应转化率达80%时的能量变化示意图。则该反应的热化学方程式为__________。
(4)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是制备HCOOH的示意图,根据要求回答问题:
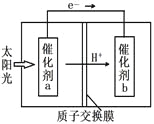
①催化剂b表面的电极反应式为__________。
②经测定,若每分钟通过质子交换膜的H+的物质的量为40mol,则每小时可产生O2_____kg。