��Ŀ����
����Ŀ����һ�̶��ݻ�Ϊ2L���ܱ������ڼ���0.2mol��N2��0.6mol��H2����һ�������·������·�Ӧ��N2(g)��3H2(g)2NH3(g)��H��0
(1)ƽ�ⳣ���ı���ʽK=__________���÷�Ӧ450����ƽ�ⳣ��__________500��ʱ��ƽ�ⳣ��(����>������<������=��)��
(2)������������˵��������Ӧ�Ѵ�ƽ�����__________
A��3����(H2)��2����(NH3)
B�������������ƽ����Է���������ʱ����仯
C��������������ܶȲ���ʱ����仯
D������������ķ�����������ʱ����仯
(3)������Ӧ����5����ʱ�ﵽƽ�⣬���NH3�����ʵ���Ϊ0.2mol����ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ����Ӧ������(N2)Ϊ__________mol/(L��min)��NH3���������__________
(4)���������������䣬����ʼͶ����ΪamolN2��bmolH2��cmolNH3��Ҳ�ɵõ���������ͬ��ƽ�⣬��a��b��c�������ϵʽ��__________��
(5)��6����ʱ�����������������䣬������ͨ��0.2mol��N2��0.6mol��H2��8����ʱ�ﵽƽ�⣬N2��ת����__________(����������������С������������)��
���𰸡�![]() > BD 0.01 33.3% a+
> BD 0.01 33.3% a+![]() =0.2��b+
=0.2��b+![]() =0.6 ����
=0.6 ����
��������
(1)���ڷ��ȷ�Ӧ���¶�Խ�ߣ�ƽ�ⳣ��ԽС��
(2)��Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ�ƽ��ʱ�������ʵ����ʵ�����Ũ�ȵȲ��ٷ����仯�����ɴ˽����жϣ�
(3)���ݻ�ѧ��Ӧ���ʹ�ʽ�����㷴Ӧ���ʣ���������������ڸ���������ʵ���������������ʵ������㣻
(4���ݼ���ת����˼���ϵ�Чƽ��֪ʶ�������
(5)ת����ѹǿ�ĸı��ƽ���ƶ���Ӱ������жϡ�
(1)���ݷ�Ӧ����ʽ�ɵ�ƽ�ⳣ������ʽΪ��K=![]() ���÷�Ӧ�Ƿ��ȵģ����ڷ��ȷ�Ӧ���¶�Խ�ߣ�ƽ�ⳣ��ԽС������
���÷�Ӧ�Ƿ��ȵģ����ڷ��ȷ�Ӧ���¶�Խ�ߣ�ƽ�ⳣ��ԽС������![]() ��ƽ�ⳣ��>
��ƽ�ⳣ��>![]() ʱ��ƽ�ⳣ�����ʴ𰸣�
ʱ��ƽ�ⳣ�����ʴ𰸣�![]() ��>��
��>��
(2)A. 3����(H2)��2����(NH3)ʱ��Ӧû�дﵽƽ��״̬����A��ѡ��
B.�����������ƽ����Է�����![]() ������ƽ��Ĺ�����mʼ�ղ��䣬n�DZ仯�ģ�����ƽ��Ĺ�����
������ƽ��Ĺ�����mʼ�ղ��䣬n�DZ仯�ģ�����ƽ��Ĺ�����![]() �DZ仯�ģ������������ƽ����Է���������ʱ����仯��˵����Ӧ�ﵽƽ�⣬��Bѡ��
�DZ仯�ģ������������ƽ����Է���������ʱ����仯��˵����Ӧ�ﵽƽ�⣬��Bѡ��
C.������������ܶ�![]() ���ܶ�ʼ���Dz���ʱ����仯��һ����ֵ��������������ܶȲ���ʱ����仯����˵����Ӧ�ﵽƽ�⣬��C��ѡ��
���ܶ�ʼ���Dz���ʱ����仯��һ����ֵ��������������ܶȲ���ʱ����仯����˵����Ӧ�ﵽƽ�⣬��C��ѡ��
D.����������ķ�����������ʱ����仯֤�������Ũ�ȱ��ֲ����ˣ�˵����Ӧ�ﵽƽ�⣬��Dѡ��
��ѡBD��
(3)��5����ʱ�ﵽƽ�⣬���NH3�����ʵ���Ϊ0.2mol�����Լ�С�ĵ������ʵ���Ϊ0.1mol��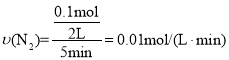 ��ͬʱ��С���������ʵ���Ϊ0.3mol����ʣ�൪�������ʵ���Ϊ0.1mol��ʣ�����������ʵ���Ϊ0.3mol��ƽ��ʱ����������ʵ���Ϊ��0.1mol+0.3mol+0.2mol=0.6mol���������������=
��ͬʱ��С���������ʵ���Ϊ0.3mol����ʣ�൪�������ʵ���Ϊ0.1mol��ʣ�����������ʵ���Ϊ0.3mol��ƽ��ʱ����������ʵ���Ϊ��0.1mol+0.3mol+0.2mol=0.6mol���������������=![]() ���ʴ�Ϊ��0.01��33.3%��
���ʴ�Ϊ��0.01��33.3%��
(4)��ʼͶ����ΪamolN2��bmolH2��cmolNH3������ת��Ϊ�������������൱��Ͷ��Ϊ��![]() �ĵ�����
�ĵ�����![]() ���������õ���������ͬ��ƽ�⣬��
���������õ���������ͬ��ƽ�⣬��![]() ��
��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��![]() ��
��
(5)��6���ӣ����������������䣬������ͨ��0.2mol ��N2��0.6mol��H2���൱������ѹǿ��ƽ��������Ӧ�����ƶ���N2��ת�������ʴ�Ϊ������

����Ŀ������ƽ�ⳣ��(��Ka��ʾ)�Ĵ�С�����жϵ���ʵ����ǿ����25��ʱ���й����ʵĵ���ƽ�ⳣ�����±���ʾ��
��ѧʽ | HF | H2CO3 | HClO |
����ƽ�� ����(Ka) | 7.2��10-4 | K1=4.4��10-7 K2=4.7��10-11 | 3.0��10-8 |
(1)��Ũ��Ϊ0.1mol��L-1HF��Һ��ˮϡ��һ��(�����¶Ȳ���)�����и����������___��
A��c(H+) B��c(H+)��c(OH-) C��![]() D��
D��![]()
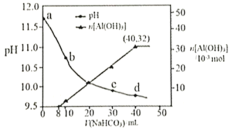
(2)25��ʱ����20mL0.1mol��L-1������м���VmL0.1mol��L-1NaOH��Һ����û����Һ��pH�仯������ͼ��ʾ������˵����ȷ����___��
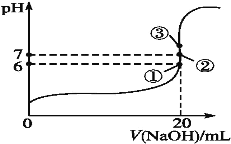
A��pH=3��HF��Һ��pH=11��NaF��Һ�У���ˮ�������c(H+)���
B���ٵ�ʱpH=6����ʱ��Һ��c(F-)-c(Na+)=9.9��10-7mol��L-1
C���ڵ�ʱ����Һ�е�c(F-)=c(Na+)
D���۵�ʱV=20mL����ʱ��Һ��c(F-)<c(Na+)=0.1mol��L-1
(3)���ʵ���Ũ�Ⱦ�Ϊ0.1mol��L-1������������Һ����Na2CO3��Һ����NaHCO3��Һ����NaF��Һ����NaClO��Һ�����������ж�pH�ɴ�С����___��
(4)Na2CO3��Һ�Լ�������Ϊ![]() ˮ���Ե�ʣ�����Ƽ�ʵ����ʵ֤֮___��
ˮ���Ե�ʣ�����Ƽ�ʵ����ʵ֤֮___��
(5)����������һֱ��Ϊ���ĺ�������ڡ�1971��������ѧ���÷���ͨ��ϸ��ĩʱ���HFO��ṹʽΪH-O-F��HFO��ˮ��Ӧ�õ�HF�ͻ�����A��ÿ����1molHFת��___mol���ӡ�