题目内容
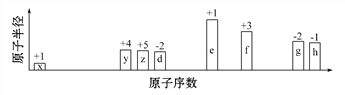
【题目】四种短周期元素在周期表中的相对位置如下表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。

请回答下列问题:
(1)元素X在周期表中的位置为________。
(2)最高价氧化物对应的水化物的浓溶液与其氢化物能发生氧化还原反应的元素是________(写元素符号)。
(3)XW2的电子式为________。
(4)Z的最高价氧化物对应的水化物的化学式为________。
(5)W和Y形成的一种二元化合物具有色温效应,其相对分子质量在170-190之间,且W的质量分数约为70%,该化合物的化学式为________。
【答案】 第二周期IVA族 S ![]() H3PO4 S4N4
H3PO4 S4N4
【解析】Z元素原子核外电子总数是其最外层电子数的3倍,根据四种短周期元素在周期表中的相对位置可知Z是第三周期元素,设Z的最外层电子数是x,则2+8+x=3x,解得x=5,因此Z是P,所以X是C,Y是N,W是S。则
(1)C的原子序数是6,则元素C位于周期表中的位置第二周期第IVA族。(2)硫元素的最高价氧化物对应的水化物的浓溶液浓硫酸与其氢化物H2S能发生氧化还原反应生成单质S和SO2;(3)CS2是共价化合物,电子式为![]() 。(4)P的最高价氧化物对应的水化物的化学式为H3PO4。(5)W和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且W的质量分数约为70%,则S原子的个数介于
。(4)P的最高价氧化物对应的水化物的化学式为H3PO4。(5)W和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且W的质量分数约为70%,则S原子的个数介于![]() 和
和![]() ,因此S原子的个数是4,因此相对分子质量约是
,因此S原子的个数是4,因此相对分子质量约是![]() ,则N原子个数是
,则N原子个数是![]() ,则该化合物的化学式为S4N4。
,则该化合物的化学式为S4N4。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】氯化亚铜(CuCl)广泛用于化工、印染、有机合成等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产氯化亚铜的工艺过程如下图所示。
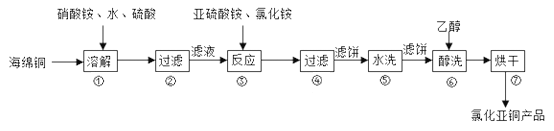
回答下列问题:
(1)CuCl中Cu元素在周期表中的位置为___________。
(2)步骤①中N元素被还原为最低价,则Cu溶解的离子方程式为________。溶解温度应控制在60~70℃,原因是______________。
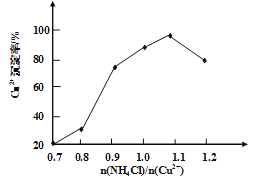
(3)写出步骤③中主要反应的离子方程式________。(NH4)2SO3要适当过量,目的有:保证Cu2+的还原速率,__________。已知NH4Cl、Cu2+的物质的量之比![]() 与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定浓度后氯化亚铜的沉淀率减少,原因是________。
与Cu2+沉淀率的关系如图所示,当氯化铵用量增加到一定浓度后氯化亚铜的沉淀率减少,原因是________。
(4)步骤⑥加入乙醇洗涤的目的是__________。
(5)氯化亚铜的定量分析:
①称取样品0.250g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解;
②用0.100mol·L-1硫酸铈[Ce(SO4)2]标准溶液测定。已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+。
三次平衡实验结果如下表(平衡实验结果相差不能超过1%):
平衡实验次数 | 1 | 2 | 3 |
0.250g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为_______(结果保留3位有效数字)。