题目内容
【题目】用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
1)、A元素是 ;B元素是 ;C元素是 (用元素符号表示)。
2)、D是由两种元素组成的双原子分子,其分子式是 。
3)、E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是 。
4)、F是由两种元素组成的三原子分子,其分子式是 ,电子式是 。
5)G分子中含有4个原子,其分子式是 。
6)、H分子中含有8个原子,其分子式是 。
【答案】(1)K Cl S(2)HCl(3)F2
(4)H2S![]() (5)H2O2、PH3(6)C2H6
(5)H2O2、PH3(6)C2H6
【解析】试题分析:18e-微粒来源大体分三个部分:一是第三周期元素的气态氢化物及去H+的对应离子,二是第四周期的金属阳离子,三是由第二周期气态氢化物去掉氢原子后,两两结合得到的分子,共16种,阳离子K+、Ca2+;阴离子P3-、S2-、HS-、Cl-;分子有Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H4等。A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),则A是K,B是Cl,C是S。
(1)根据以上分析可知A元素是K,B元素是Cl,C元素是S。
(2)D是由两种元素组成的双原子分子,则其分子式是HCl。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,则其分子式是F2。
(4)F是由两种元素组成的三原子分子,其分子式是H2S,电子式是![]() 。
。
(5)G分子中含有4个原子,其分子式是H2O2或PH3。
(6)H分子中含有8个原子,其分子式是C2H6。
分子 | 离子 | |
一核18电子 | Ar | K+、Ca2+、Cl-、S2- |
二核18电子 | F2、HCl | O22-、HS- |
三核18电子 | H2S | |
四核18电子 | PH3、H2O2 | |
五核18电子 | SiH4、CH3F、NH2OH | |
六核18电子 | N2H4、CH3OH | |
其他微粒 | C2H6、CH3NH2 | N2H5+、N2H62+ |

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】下表是元素周期表的一部分,用相关化学用语回答下列问题:
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | A | B | C | D | ||||
3 | E | F | G | H | I | J | K | L |
(1)写出H、I两种元素的名称_____________、_____________。
(2)这些元素的气态氢化物中最稳定的是________________,元素A的最高价氧化物的分子式为____________,属于______________化合物(填离子或共价);
其电子式为_______________;其结构式为_______________。
(3)从E到K的元素中,______原子半径最小。元素E和J形成的化合物属于_______化合物(填离子或共价)
(4)试用实验证明E和F的金属性的强弱(简述实验内容和结论)_____________________________________________________________________________________________。
【题目】元素是构成我们生活的世界中一切物质的“原材料”。
(1)自18世纪以来,科学家们不断探索元素之谜。通过从局部到系统的研究过程,逐渐发现了元素之间的内在联系。下面列出了几位杰出科学家的研究工作。
序号 | ||||
科学家 | 纽兰兹 | 道尔顿 | 德贝莱纳 | 尚古尔多 |
工作 | 发现“八音律”,指出从某一指定的元素起,第八个元素是第一个元素的某种重复 | 创立近代原子论,率先开始相对原子质量的测定工作 | 发现了5组性质相似的“三元素组”,中间元素的相对原子质量为前后两种元素相对原子质量的算术平均值 | 认为各元素组之间并非毫不相关,可以用相对原子质量把它们按从小到大的顺序串联 |
上述科学家的研究按照时间先后排序合理的是_________(填数字序号)。
(2)1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。

①门捷列夫将已有元素按照相对原子质量排序,同一_________(填“横行”或“纵列”)元素性质相似。结合表中信息,猜想第4列方框中“?=70”的问号表达的含义是_________,第5列方框中“Te=128?” 的问号表达的含义是_________。
②到20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满。而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量递增呈现周期性变化,而是随着原子序数(核电荷数)递增呈现周期性变化。其本质原因是_________(填字母序号)。
A.随着核电荷数递增,原子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
(3)在现有的元素周期表中有A、B、D、E、X、Y、Z七种短周期元素。X与Y处于同一周期,Y的最高价氧化物的水化物与强酸、强碱均能反应。Z的单质常温下为气态,同条件下相对于氢气的密度比为35.5。其余信息如图所示:
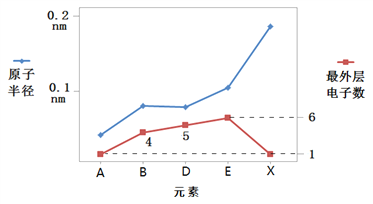
①上述七种元素中,处于第二周期的有_________(用元素符号表示,下同),X在周期表中的位置是_________。
②E的原子结构示意图为_________,写出Z元素气态氢化物的电子式:_________。
③B单质与E的最高价氧化物的水化物在一定条件下发生反应的化学方程式为_________;Y单质与X的最高价氧化物的水化物溶液反应的离子方程式为_________。
④B和D的最高价氧化物的水化物的化学式分别为_________、_________,二者酸性前者_________(填“强于”或“弱于”)后者,原因是B和D的非金属性有差异,利用原子结构解释产生差异的原因: _________。



