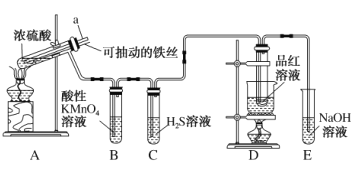
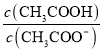题目内容
【题目】锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件、医药及化工等领域。以辉锑矿(主要成分为的Sb2S3,还含有As2S5、PbS、CuO和SiO2等)为原料制备金属锑,其一种工艺流程如下:
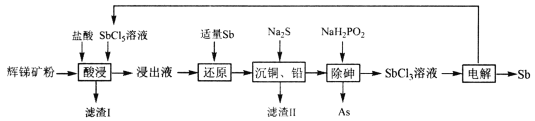
已知:I.浸出液主要含盐酸和SbC13,还含SbC15、CuC12、AsC13和PbC12等杂质。
II.25℃时,Ksp(CuS)=1.0×10-36,Ksp(PbS)=9.0×10-29。
回答下列问题:
(1)“酸浸”过程中SbC15和Sb2S3发生反应有一种单质和还原产物SbC13生成,则滤渣I的成分是_______________(填化学式)。
(2)写出“还原”反应的化学方程式_____________________。
(3)已知浸出液中c(Cu2+)=0.0lmol·L-1、c(Pb2+)=0.10mol·L-1。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是_____________(填化学式);当CuS、PbS共沉时,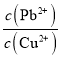 =_________。
=_________。
(4)在“除砷”过程中,氧化产物为H3PO4,则该反应中氧化剂、还原剂的物质的量之比为__________________。
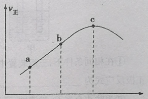
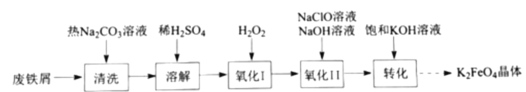
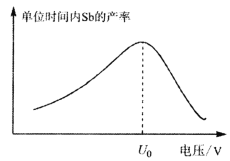
(5)在“电解”过程中,以惰性材料为电极,阳极的电极反应式为___________________,继而发生反应_________________(写出离子方程式)以实现溶液中Sb元素的循环使用。“电解”中单位时间内锑的产率与电压大小关系如图所示。当电压超过U0V时,单位时间内产率降低的原因可能是________________。
【答案】S、SiO2 3SbCl5+2Sb=5SbCl3 CuS 9.0×107 4:3 2Cl--2e-=Cl2![]() Sb3+-2e-=Sb5+ H+参与了电极反应
Sb3+-2e-=Sb5+ H+参与了电极反应
【解析】
由工艺流程可知,辉锑矿粉经盐酸、五氯化锑溶液浸取后,过滤,向浸出液中加入适量的锑粉把过量的五氯化锑还原,然后再加入适量的硫化钠把溶液中的铜离子和铅离子沉淀,过滤,再向滤液中加入NaH2PO2除砷,得到三氯化锑溶液,电解该溶液得到锑和五氯化锑,五氯化锑循环利用。
(1)根据浸出液成分可知,“酸浸”过程中SbC15和Sb2S3反应有S和SbC13生成,则滤渣I的成分是S、SiO2。
(2)“还原”过程中Sb将SbCl5还原为SbCl3,反应的化学方程式3SbCl5+2Sb=5SbCl3。
(3)浸出液中c(Cu2+)=0.01 mol·L-1、c(Pb2+)=0.10 mol·L-1,常温下,Ksp(CuS)=1.0×10-36,铜离子开始沉淀需要的硫离子浓度为1.0![]() 10-34mol/L;Ksp(PbS)=9.0×10-29,铅离子开始沉淀需要的硫离子浓度为9.0
10-34mol/L;Ksp(PbS)=9.0×10-29,铅离子开始沉淀需要的硫离子浓度为9.0![]() 10-28mol/L;故在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是CuS;当CuS、PbS共沉时,
10-28mol/L;故在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是CuS;当CuS、PbS共沉时, 。
。
(4) 在“除砷”过程中,NaH2PO2是还原剂,其氧化产物为H3PO4,P的化合价由+1升高到+5,而As的化合价由+3降到0,根据得失电子守恒,该反应中氧化剂、还原剂的物质的量之比4:3。。
(5) 在“电解”过程中,以惰性材料为电极,阳极发生氧化反应,阳极的电极反应式为2Cl--2e-=Cl2![]() ,继而发生反应Sb3+-2e-=Sb5+;由“电解”中锑的产率与电压大小关系示意图可知,当电压超过U0V时,锑的产率降低,其原因可能是H+参与了电极反应。
,继而发生反应Sb3+-2e-=Sb5+;由“电解”中锑的产率与电压大小关系示意图可知,当电压超过U0V时,锑的产率降低,其原因可能是H+参与了电极反应。