题目内容
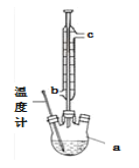
【题目】实验室为探究铜与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法错误的是( )
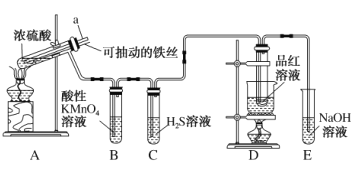
A.装置B、C的目的分别是验证二氧化硫的还原性、氧化性
B.实验结束后可向装置A的溶液中加水,以验证是否有蓝色溶液生成
C.装置D的目的是验证SO2的漂白性及漂白的不稳定性
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸
【答案】B
【解析】
A. 酸性高锰酸钾溶液具有强氧化性,装置B中酸性高锰酸钾溶液褪色,体现SO2的还原性,H2S溶液与SO2反应生成淡黄色沉淀生成,其反应方程式为:2H2S+SO2=3S↓+2H2O,体现SO2的氧化性,A正确;
B. Cu与浓硫酸反应生成硫酸铜,加水则溶液呈蓝色,但因反应后的溶液中混有浓硫酸,在反应后的溶液中直接加水,放出大量的热,可导致酸液飞溅,应将反应后的酸液沿烧杯内壁缓缓加入到盛有水的烧杯中,并不断用玻璃棒搅拌,B错误;
C. 品红溶液褪色说明SO2具有漂白性,再加热,品红溶液恢复到原来的颜色,说明SO2的漂白性不稳定,是可逆的,不彻底的,C正确;
D. 导管a的作用是使内外压强相同,防止装置B中的溶液倒吸,D正确;
故答案为:B。

【题目】(1)T1K时,将1mol二甲醚引入一个抽空的150L恒容容器中,发生分解反应:CH3OCH3(g)CH4(g)+H2(g)+CO(g)。
反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
①由此计算:反应达平衡时,二甲醚的分解率为______,该温度下平衡常数Kc=______。(填数值)
②若升高温度,CH3OCH3的浓度增大,则该反应为______反应(填“放热”或“吸热”),在恒温恒容下,若要缩短上述反应达到平衡的时间,可采取的措施有______、______。
(2)在T2K、1.0×104kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)CH3CHO(g)。反应速率v=v正v逆=k正p(CO)p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5(kPa)-1,当CO转化率为20%时,![]() =______。
=______。
(3)工业上常用高浓度的K2CO3溶液吸收CO2得到溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示:
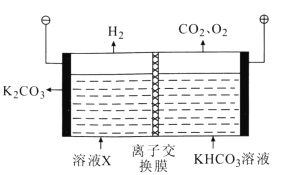
①在阳极区发生的反应包括(电极反应)______和H++![]() =CO2↑+H2O。
=CO2↑+H2O。
②用离子方程式表示![]() 在阴极区再生的过程:______。
在阴极区再生的过程:______。