题目内容
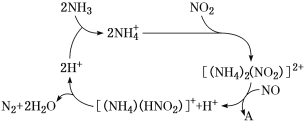
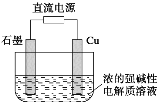
【题目】酸性介质中,金属铜与氢叠氮酸(NH3)构成的原电池如图所示,电池总反应方程式为2Cu+2C1-+HN3+3H+===2CuC1(s)+N2↑+NH![]() 。下列叙述错误的是
。下列叙述错误的是
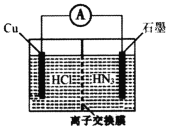
A.离子交换膜为阳离子交换膜
B.若将盐酸换成NaC1,电池的运行效率将会下降
C.负极的电极反应式为Cu—e-+C1-===CuC1(s)
D.当外电路中流过0.1mol电子时,交换膜左侧离子减少0.1mol
【答案】D
【解析】
电池总反应为2Cu+2Cl-+HN3+3H+=2CuCl(s)+N2↑+NH4+,Cu元素的化合价由0价升至+1价,Cu发生氧化反应,原电池中负极发生氧化反应,正极发生还原反应,负极电极反应式为Cu-e-+Cl-=CuCl(s),总反应减去负极电极反应式得正极电极反应式为HN3+2e-+3H+=NH4++N2↑;结合装置图Cu为负极,石墨为正极;原电池工作时,阳离子向正极移动。
A. 根据电极反应式和平衡电荷,离子交换膜将负极室的H+迁移到正极室,离子交换膜为阳离子交换膜,A正确;
B. 若将盐酸换成NaCl,NaCl溶液呈中性,则正极HN3还原成NH3,电池的运行效率会下降,B正确;
C. 负极的电极反应式为Cu—e-+C1-===CuC1(s),C正确;
D. 当电路中流过0.1mol电子时,左侧电极反应式为Cu-e-+Cl-=CuCl(s),该电极反应消耗0.1molCl-,为了平衡电荷,有0.1molH+迁移到右侧,交换膜左侧离子减少0.2mol,D错误;
答案为D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目