题目内容
16.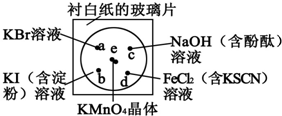 某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol•L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)
某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol•L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)(1)实验室制备Cl2的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O..该反应中发生反应的氧化剂和还原剂的物质的量之比为1:2.
(2)b处的实验现象溶液由无色变为蓝色,d处的实验现象溶液由浅绿色变为红色.
(3)标准状况下,当有0.224L Cl2被NaOH溶液吸收后,转移电子的物质的量为0.01mol.
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?能(填“能”或“不能”),若能,其氧化性由强到弱的顺序是KMnO4>Cl2>FeCl3.
分析 (1)实验室用二氧化锰与浓盐酸在加热条件下反应制取氯气;二氧化锰为氧化剂,氯化氢为还原剂,氯化氢中有一半做还原剂,另一半表现酸性;
(2)氯气的氧化性强于碘、三价铁离子,能够氧化碘离子生成单质碘,能够氧化二价铁离子生成三价铁离子;
(3)计算氯气物质的量,结合化学方程式定量关系计算得到电子转移;
(4)依据氧化还原反应中氧化剂氧化性强于氧化产物的氧化性判断解答.
解答 解:(1)二氧化锰与浓盐酸在加热条件下生成氯化锰、氯气和水,方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
依据方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,二氧化锰做氧化剂,氯化氢做还原剂,消耗1mol二氧化锰,反应掉4mol氯化氢,其中有2mol做还原剂,所以氧化剂和还原剂的物质的量之比为1:2;
故答案为:MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O;1:2;
(2)氯气氧化性强于碘,能够氧化碘离子生成单质碘,碘遇到淀粉变蓝;氯气氧化性强于三价铁离子,能够氧化二价铁离子生成三价铁离子,所以溶液由浅绿色变为红色;
故答案为:溶液由无色变为蓝色;溶液由浅绿色变为红色;
(3)标准状况下,当有0.224L Cl2被NaOH溶液吸收后,氯气物质的量=$\frac{0.224L}{22.4L/mol}$=0.01mol,反应为Cl2+2NaOH=NaCl+NaClO+H2O,氯元素化合价0价变化为-1价和+1价,1mol氯气反应电子转移1mol,0.01mol氯气反应电子转移0.01mol,
故答案为:0.01;
(4)氧化还原反应中氧化剂氧化性强于氧化产物的氧化性.
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,高锰酸钾为氧化剂,氯气为氧化产物,所以氧化性:KMnO4>Cl2;氯气与二价铁离子反应生成三价铁离子,则氧化性:Cl2>FeCl3;
所以氧化性顺序为:KMnO4>Cl2>FeCl3;
故答案为:能;KMnO4>Cl2>FeCl3;
点评 本题考查了氯气的实验室制备和性质检验,氧化还原反应知识,熟悉反应原理及氧化还原反应规律是解题关键,题目难度不大.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案| A. | 物质的量 | B. | 密度 | C. | 质量 | D. | 含有的原子数 |
| A. | 碳酸氢铵溶液与足量氢氧化钠溶液反应 NH${\;}_{4}^{+}$+OH-=NH3•H2O | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 乙醛与银氨溶液在热水浴中的反应CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$CH3COO-+NH4++2Ag↓+3NH3+H2O | |
| D. | 苯酚钠溶液中通入少量的CO2 2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
| A. | c(ClO-)=1.0 mol•L-1的溶液:Na+、SO32-、NO3-、SO42- | |
| B. | 0.1 mol•L-1Na2S溶液:SO42-、K+、Cl-、Cu2+ | |
| C. | 0.1 mol•L-1AgNO3 溶液:H+、K+、SO42-、Br- | |
| D. | 0.1 mol•L-1NaAlO2 溶液:OH-、Na+、Cl-、SO42- |
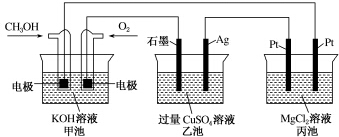
| A. | 若将乙池电解液换成AgNO3溶液,则可以实现在石墨棒上镀银 | |
| B. | 甲池通入CH3OH的电极反应式为CH3OH+6e-+2H2O═CO$\stackrel{2-}{3}$+8H+ | |
| C. | 反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 | |
| D. | 甲池中消耗224mL(标准状况下)O2,此时丙池中理论上产生1.16g固体 |
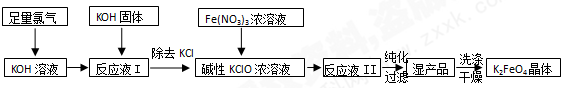
 液480mL.
液480mL.