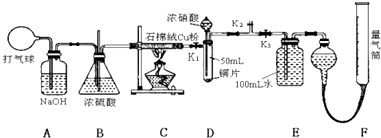
题目内容
8.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | c(ClO-)=1.0 mol•L-1的溶液:Na+、SO32-、NO3-、SO42- | |
| B. | 0.1 mol•L-1Na2S溶液:SO42-、K+、Cl-、Cu2+ | |
| C. | 0.1 mol•L-1AgNO3 溶液:H+、K+、SO42-、Br- | |
| D. | 0.1 mol•L-1NaAlO2 溶液:OH-、Na+、Cl-、SO42- |
分析 A.离子之间发生氧化还原反应;
B.离子之间结合生成沉淀;
C.离子之间结合生成沉淀;
D.碱性溶液中该组离子之间不反应.
解答 解:A.ClO-、SO32-发生氧化还原反应,不能大量共存,故A错误;
B.S2-、Cu2+结合生成沉淀,不能大量共存,故B错误;
C.Ag+分别与SO42-、Br-结合生成沉淀,不能大量共存,故C错误;
D.碱性溶液中该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
3.下列化学用语的表达或使用正确的是( )
| A. | 白磷的分子式:P | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 氟离子的结构示意图: | D. | 过氧化氢的电子式: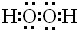 |
20.用10mL的0.1mol•L-1 BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是( )
| A. | 3:2:2 | B. | 1:2:3 | C. | 1:3:3 | D. | 3:1:1 |
18.下列物质中含原子个数最多的是( )
| A. | 0.4 molO2 | B. | 4℃时5.4mL水 | ||
| C. | 10g氖 | D. | 6.02×1022 个CO2分子 |

 .
.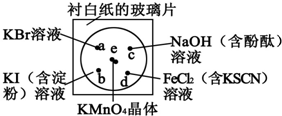 某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol•L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)
某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol•L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)