ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΗυΨίœ¬Ν– Β―ι≤ΌΉςΚΆœ÷œσΥυΉω≥ωΒΡΫα¬έ’ΐ»ΖΒΡ «
―Γœν | Β―ι≤ΌΉςΚΆœ÷œσ | Ϋα¬έ |
A | œύΆ§ΧθΦΰœ¬Θ§≈®Ε»ΨυΈΣ1molΓΛL1ΒΡCH3COOHΚΆHClΖ÷±πΉωΒΦΒγ–‘ Β―ιΘ§CH3COOH»ή“ΚΕ‘”ΠΒΡΒΤ≈ίΫœΑΒ | CH3COOH «»θΒγΫβ÷ |
B | œρ≈®Ε»ΨυΈΣ0.1 molΓΛL1ΒΡMgCl2ΓΔCuCl2ΜλΚœ»ή“Κ÷–÷πΒΈΦ”»κΑ±Υ°Θ§œ»≥ωœ÷άΕ…Ϊ≥ΝΒμ | Ksp[Mg(OH)2]ΘΦKsp[Cu(OH)2] |
C | Ζ÷±πœρpHΘΫ3ΒΡ―ΈΥαΚΆ≤ίΥα»ή“Κ÷–Φ”»κΉψΝΩ–ΩΝΘΘ§“ΜΕΈ ±ΦδΚσ≤ίΥαΖ¥”ΠΥΌ¬ ΗϋΩλ | ≤ίΥα «Εΰ‘ΣΥα |
D | “Έ¬œ¬Θ§”ΟpH ‘÷Ϋ≤βΒΟΘΚ0.1 molLΘ≠1 Na2SO3»ή“ΚΒΡpHΈΣ10ΘΜ0.1 molLΘ≠1 NaHSO3»ή“ΚpHΈΣ5 | HSO |
A.AB.BC.CD.D
ΓΨ¥πΑΗΓΩA
ΓΨΫβΈωΓΩ
AΘ°Β»≈®Ε» ±―ΈΥαΆξ»ΪΒγάκΘ§¥ΉΥα≤ΩΖ÷ΒγάκΘ§‘ρCH3COOH»ή“ΚΕ‘”ΠΒΡΒΤ≈ίΫœΑΒΘ§ΡήΙΜΥΒΟςCH3COOH «»θΒγΫβ÷ Θ§Ι A’ΐ»ΖΘΜ
BΘ°Ksp–ΓΒΡœ»≥ΝΒμΘ§œρ≈®Ε»ΨυΈΣ0.1 molΓΛL1ΒΡMgCl2ΓΔCuCl2ΜλΚœ»ή“Κ÷–÷πΒΈΦ”»κΑ±Υ°Θ§œ»≥ωœ÷άΕ…Ϊ≥ΝΒμΘ§ΥΒΟςKsp[Mg(OH)2]ΘΨKsp[Cu(OH)2]Θ§Ι B¥μΈσΘΜ
CΘ°pH=3ΒΡ―ΈΥαΚΆ≤ίΥαΘ§≤ίΥα≈®Ε»¥σΘ§ΥφΉ≈Ζ¥”ΠΒΡΫχ––Θ§≤ίΥαΦΧ–χΒγάκΘ§“ΜΕΈ ±ΦδΚσ≤ίΥαΖ¥”ΠΥΌ¬ ±»―ΈΥαΩλΘ§÷ΜΡήΥΒΟς≤ίΥαΈΣ»θΥαΘ§≤ΜΡήΥΒΟς≤ίΥαΈΣΕΰ‘ΣΥαΘ§Ι C¥μΈσΘΜ
DΘ°0.1 molLΘ≠1 Na2SO3»ή“ΚΒΡpHΈΣ10ΘΜ0.1 molLΘ≠1 NaHSO3»ή“ΚpHΈΣ5Θ§ΥΒΟςNa2SO3»ή“ΚΥ°Ϋβœ‘Φν–‘Θ§NaHSO3»ή“ΚΒγάκœ‘Υα–‘Θ§‘ρHSO3-ΫαΚœH+ΒΡΡήΝΠ±»SO32-ΒΡ»θΘ§Ι D¥μΈσΘΜ
Ι ―ΓAΓΘ

 ΩΣ–Ρ ‘ΨμΤΎΡ©≥ε¥Χ100Ζ÷œΒΝ–¥πΑΗ
ΩΣ–Ρ ‘ΨμΤΎΡ©≥ε¥Χ100Ζ÷œΒΝ–¥πΑΗ ΥΪΜυΆ§≤ΫΒΦΚΫ―ΒΝΖœΒΝ–¥πΑΗ
ΥΪΜυΆ§≤ΫΒΦΚΫ―ΒΝΖœΒΝ–¥πΑΗ ΜΤΗ‘–ΓΉ¥‘ΣΆ§≤ΫΦΤΥψΧλΧλΝΖœΒΝ–¥πΑΗ
ΜΤΗ‘–ΓΉ¥‘ΣΆ§≤ΫΦΤΥψΧλΧλΝΖœΒΝ–¥πΑΗΓΨΧβΡΩΓΩΈ“Ιζ’ΰΗ°≥–≈ΒΘ§ΒΫ2020ΡξΘ§ΒΞΈΜGDP CO2≈≈Ζ≈ΝΩ±»2005Ρξœ¬ΫΒ40%Θ≠45%ΓΘ«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
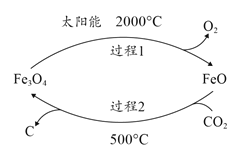
(1)άϊ”ΟΧΪ―τΡήΙΛ“’Ω…ΫΪFe3O4ΉΣΜ·ΈΣFeOΘ§»ΜΚσάϊ”ΟFeO≤ΕΜώCO2Ω…ΒΟΧΩΚΎΘ§ΤδΝς≥Χ»γ…œΆΦΥυ ΨΓΘΗΟ―≠ΜΖ÷–Fe3O4Ω… ”ΈΣ_______Θ®ΧνΓΑ¥ΏΜ·ΦΝΓ±ΓΔΓΑ÷–Φδ≤ζΈοΓ±Θ©Θ§Ιΐ≥Χ2≤ΕΜώ1mo1CO2ΉΣ“ΤΒγΉ”ΒΡΈο÷ ΒΡΝΩ «_______molΓΘ
(2)“‘CO2ΚΆNH3ΈΣ‘≠ΝœΚœ≥…ΡρΥΊ[CO(NH2)2]Θ§Ζ¥”Π»γœ¬:
2NH3(g)ΘΪCO2(g)ΘΫH2NCOONH4(s) ΠΛHΘΫΘ≠1595kJΓΛmolΘ≠1
H2NCOONH4 (s)ΘΫCO(NH2)2(s)ΘΪH2O(g) ΠΛHΘΫΘΪ1165kJΓΛmolΘ≠1
H2O(l)ΘΫH2O(g) ΠΛHΘΫΘΪ44.0kJΓΛmolΘ≠1
CO2(g)”κNH3(g)Κœ≥…ΡρΥΊΚΆ“ΚΧ§Υ°ΒΡ»»Μ·―ßΖΫ≥Χ Ϋ_______________________ΘΜ
(3)CH4-CO2¥ΏΜ·÷Ί’ϊΩ…“‘ΒΟΒΫ»ΦΝœCOΚΆH2ΓΘ“ΜΕ®ΧθΦΰœ¬‘ΎΚψ»ίΒΡΟή±’»ίΤς÷–ΖΔ…ζΖ¥”ΠΘΚCO2(g)ΘΪCH4(g)![]() 2CO(g)ΘΪ2H2(g)ΡήΙΜΥΒΟς…œ ωΖ¥”Π“―¥οΒΫΤΫΚβΉ¥Χ§ΒΡ «______Θ®ΧνΉ÷ΡΗ–ρΚ≈Θ©ΓΘ
2CO(g)ΘΪ2H2(g)ΡήΙΜΥΒΟς…œ ωΖ¥”Π“―¥οΒΫΤΫΚβΉ¥Χ§ΒΡ «______Θ®ΧνΉ÷ΡΗ–ρΚ≈Θ©ΓΘ
AΘ°CO2ΚΆCH4ΒΡ≈®Ε»œύΒ»
BΘ°v’ΐ(CO2)ΘΫ2vΡφ(CO)
CΘ°ΟΩΕœΝ―4molCΓΣHΦϋΒΡΆ§ ±Θ§ΕœΝ―2molHΓΣHΦϋ
DΘ°»ίΤς÷–ΜλΚœΤχΧεΒΡΤΫΨυœύΕ‘Ζ÷Ή”÷ ΝΩ±Θ≥÷≤Μ±δ
EΘ°»ίΤς÷–ΜλΚœΤχΧεΒΡΟήΕ»±Θ≥÷≤Μ±δ
(4)CO2 «“Μ÷÷Έ¬ “ΤχΧεΘ§ΒΪΤδ±Ψ…μΈόΕΨΘ§¥ΠάμΖœΤχ ±≥ΘΫΪ“Μ–©”–ΕΨΈο÷ ΉΣΜ·ΈΣCO2ΓΘ“ΜΕ®Έ¬Ε»œ¬Θ§‘Ύ»ΐΗω»ίΜΐΨυΈΣ2.0 LΒΡΟή±’»ίΤς÷–ΖΔ…ζΖ¥”ΠΘΚ2NO(g)ΘΪ2CO(g)![]() N2(g)ΘΪ2CO2(g)
N2(g)ΘΪ2CO2(g)
≤ΜΆ§Έ¬Ε»œ¬Θ§»ίΤς÷–ΗςΈο÷ Τπ ΦΚΆΤΫΚβ ±ΒΡΈο÷ ΒΡΝΩ»γœ¬±μΥυ ΨΘΚ
»ίΤς | Έ¬Ε»/Γφ | Τπ ΦΈο÷ ΒΡΝΩ/mol | ΤΫΚβ ±Έο÷ ΒΡΝΩ/mol | |
NO(g) | CO(g) | CO2 | ||
ΦΉ | 50 | 0.2 | 0.2 | 0.12 |
““ | 100 | 0.2 | 0.2 | 0.1 |
±ϊ | 100 | 0.3 | 0.3 | |
œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «___________
AΘ°ΗΟΖ¥”ΠΒΡ’ΐΖ¥”ΠΈΣΈϋ»»Ζ¥”Π
BΘ°50Γφ ±Θ§»τΤπ Φ ±œρΦΉ÷–≥δ»κ0.1 mol N2ΚΆ0.2 mol CO2Θ§‘ρ¥οΤΫΚβ ±N2ΒΡΉΣΜ·¬ ΈΣ40%
CΘ°100Γφ ±Θ§»τΤπ Φ ±œρ““÷–≥δ»κΒΡNOΓΔCOΓΔN2ΚΆCO2ΨυΈΣ0.40 molΘ§‘ρ¥Υ ±v’ΐΘΨvΡφ
DΘ°¥οΒΫΤΫΚβ ±Θ§±ϊ÷–CO2ΒΡΧεΜΐΖ÷ ΐ±»““÷–ΒΡ–Γ