题目内容
含苯酚的工业废水处理的流程图如图所示:
(1)上述流程里,设备Ⅰ中进行的是_________操作(填写操作名称)。实验室里这一步
操作可以用____________(填写仪器名称)进行。
(2)由设备Ⅱ进入设备Ⅲ的物质A是_____ ____。由设备Ⅲ进入设备Ⅳ的物质B是______________。(均填写物质的化学式)
(3)在设备Ⅲ中发生反应的化学方程式为:_______ ________。
(4)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和________。通过________操作(填写操作名称),可以使产物相互分离。
(5)图中,能循环使用的物质是C6H6、CaO、________、__________。(均填写物质的化学式)
(1)萃取(或萃取、分液),分液漏斗 (2)C6H5ONa NaHCO3
(3)C6H5ONa+CO2+H2O C6H5OH+NaHCO3(4)CaCO3 过滤(5)NaOH水溶液 CO2
C6H5OH+NaHCO3(4)CaCO3 过滤(5)NaOH水溶液 CO2
解析试题分析:在设备Ⅰ中废水中的苯酚不容易溶解于水而容易溶解于苯中,苯与水互不相溶。所以在该装置中进行的操作是萃取(或萃取、分液)。使用的仪器是分液漏斗。在设备Ⅱ中发生反应:C6H5-OH+NaOH C6H5-ONa+H2O.在设备Ⅲ中发生反应:C6H5-ONa+H2O+CO2= C6H5-OH+NaHCO3.苯酚被分离出来,NaHCO3及未反应的C6H5-ONa进入设备Ⅳ。在设备Ⅳ中,发生反应CaO+H2O=Ca(OH)2, Ca(OH)2+NaHCO3= CaCO3↓+ NaOH+H2O.产生的CaCO3沉淀通过过滤分离出来。由物质制备流程示意图可知:能循环使用的物质是C6H6、CaO:CO2、NaOH溶液。
C6H5-ONa+H2O.在设备Ⅲ中发生反应:C6H5-ONa+H2O+CO2= C6H5-OH+NaHCO3.苯酚被分离出来,NaHCO3及未反应的C6H5-ONa进入设备Ⅳ。在设备Ⅳ中,发生反应CaO+H2O=Ca(OH)2, Ca(OH)2+NaHCO3= CaCO3↓+ NaOH+H2O.产生的CaCO3沉淀通过过滤分离出来。由物质制备流程示意图可知:能循环使用的物质是C6H6、CaO:CO2、NaOH溶液。
H考点:考查含苯酚的工业废水处理的反应原理、分离混合物的方法、物质的循环利用等知识。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案某化学实验室产生的废液中含有Fe3+、Cu2+、Ba2+、Cl-四种离子,现设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体。
(1)沉淀1中含有的金属单质是 。
(2)氧化时加入H2O2溶液发生反应的离子方程式为 。
(3)下列物质中,可以作为试剂X的是 (填字母)。
| A.BaCl2 | B.BaCO3 |
| C.NaOH | D.Ba(OH)2 |
(5)制备氯化铁晶体过程中需保持盐酸过量,其目的是 。
(6)由过滤2得到的滤液制备BaCl2的实验操作依次为 、冷却结晶、 、洗涤、干燥。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液 | B.升华 | C.结晶 | D.分液 E.蒸馏 F.层析 G.过滤 |
(2)__ _从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)__ _分离水和汽油的混合物。
(4)__ _分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
 2Ca2++2K++Mg2++4SO42—+2H2O
2Ca2++2K++Mg2++4SO42—+2H2O


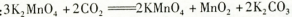


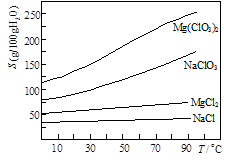
 Mg(ClO3)2+2NaCl↓,
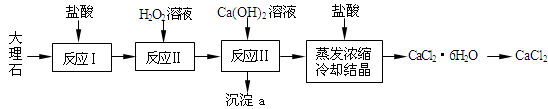
Mg(ClO3)2+2NaCl↓, 4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。

