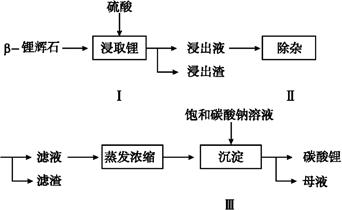
题目内容
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
已知:
①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②几种化合物的溶解度(S)随温度(T)变化曲线如图。
(1)加MgO后过滤所得滤渣的主要成分为 。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全? 。
(3)加入NaClO3饱和溶液会发生如下反应:
MgCl2+2NaClO3 Mg(ClO3)2+2NaCl↓,
Mg(ClO3)2+2NaCl↓,
请利用该反应,结合右图,制取Mg(ClO3)2·6H2O的实验步骤依次为:
①取样,加入NaClO3饱和溶液充分反应,② ;③ ;④ ;⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50g产品溶解定容成100mL溶液。
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL1.000mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/LK2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O。
2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
(4)上述产品测定中需要检查是否漏液的仪器有 。
步骤3中若滴定前不用标准液润洗滴定管,会导致最终结果偏 。(填“大”或“小”)。
(5)产品中Mg(ClO3)2·6H2O的质量分数为 。(计算结果保留两位小数)
(1)BaSO4和Fe(OH)3
(2)静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全(现象+判断1分)
(3)①蒸发结晶 ②趁热过滤 ③ 冷却结晶
(4)容量瓶 滴定管 偏小
(5)78.31%
解析试题分析:(1)过滤实验用到的仪器:漏斗、玻璃棒、烧杯、滤纸、铁架台等,其中玻璃仪器有:漏斗、玻璃棒、烧杯,加入氧化镁,调节溶液的pH为4,此时铁离子形成了沉淀氢氧化铁,钡离子已经和硫酸根离子只碱反应生成了硫酸钡沉淀,故答案为:漏斗、玻璃棒、烧杯;BaSO4和Fe(OH)3;
(2)检验硫酸根离子是否除净的方法:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42﹣沉淀完全,故答案为:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42﹣沉淀完全;
(3)根据物质的溶解度大小,溶液获得晶体的方法:蒸发结晶;趁热过滤;冷却结晶;
(4)上述产品测定中需要检查是否漏液的仪器有容量瓶和滴定管 。步骤3中若滴定前不用标准液润洗滴定管,相当于把标准液稀释了,消耗的标准液的体积就会偏高,会导致最终结果偏小。
(5)①氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3﹣+6Fe2++6H+=6Fe3++Cl﹣+3H2O;②根据化学方程式:ClO3﹣+6Fe2++6H+=6Fe3++Cl﹣+3H2O以及Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3﹣~6Fe2+,Cr2O72﹣~6Fe2+,用0.100mol?L﹣1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100mol?L﹣1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10﹣3L×1.000mol?L﹣1﹣0.009mol=0.011mol,氯酸根离子的物质的量为: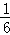 ×0.011mol,产品中Mg(ClO3)2?6H2O的质量分数:(
×0.011mol,产品中Mg(ClO3)2?6H2O的质量分数:(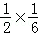 ×0.011×299g/mol)×10×
×0.011×299g/mol)×10×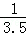 ×100%=78.3%.故答案为:78.3%。
×100%=78.3%.故答案为:78.3%。
考点:本题考查对常见金属元素及其化合物主要性质的掌握,以及对离子反应实质的认识;同时考查应用基础知识解决简单化学问题的能力以及对图表的观察、分析能力,物质溶解度概念的应用,晶体析出的方法,杂质离子的除杂原则和试剂选择。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案氯碱工业是最基本的化学工业之一,它的产品应用广泛。请回答下列问题:
(1)氯碱工业是利用电解食盐水生产 为基础的工业体系。
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,加入下列试剂的顺序合理的是 (填下列各项中序号)。
a、碳酸钠、氢氧化钠、氯化钡 b、碳酸钠、氯化钡、氢氧化钠
c、氢氧化钠、碳酸钠、氯化钡 d、氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶物 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。
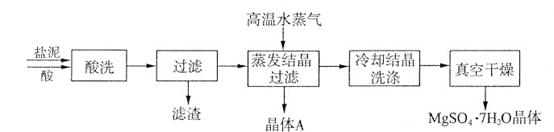
回答下列问题:
①酸洗过程中加入的酸为 ,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4。其中碳酸钙可以转化为硫酸钙的原因是 。
②过滤所得滤渣的主要成分为 。
③根据图分析,蒸发结晶过滤所得晶体A主要成分为 。

④真空干燥MgSO4·7H2O晶体的原因是 。
钴酸锂(LiCoO2)锂离子电池是一种应用广泛的新型电源,实验室尝试利用废旧钴酸锂锂离子电池回收铝、铁、铜、钴、锂元素,实验过程如下:
(1)碱浸泡过程中,铝被溶解的离子方程式为__________________________
(2)滤液A中加入草酸铵溶液,使Co元素以CoC2O4·2H2O沉淀形式析出。草酸钴是制备氧化钴及钴粉的重要原料。在空气中CoC2O4·2H2O的热分解失重数据见下表,请补充完整表中的热分解方程式。
| 序号 | 温度范围/℃ | 热分解方程式 | 固体失重率 |
| ① | 120~220 | | 19.67% |
| ② | 280~310 | | 56.10% |
(3)过滤Li2CO3时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:_____________________________________________________________
(4)最终所得的FeCl3溶液可作净水剂,试结合离子方程式解释其净水原理________________________________________________________
选择下列实验方法分离物质,将最好的分离方法的序号填在横线上。
| A.萃取分液法 | B.加热法 | C.结晶法 | D.分液法 E.过滤法 F.蒸馏法 |
(2)___________分离二氧化硅与氯化铵的化合物;
(3)___________分离水和煤油的混合物;
(4)____ _______分离碘和酒精;
(5)___________分离溴水中的溴和水。
某混合金属粉末,除Mg外还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。
所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
该小组探究过程如下:
●查阅资料:
| ①镁、铝、锌都是银白色的金属 ②锌(Zn)可以与NaOH溶液反应生成H2 ③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O ④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+ |
(1)假设①:该混合金属粉末中除镁外还含有铝元素;
假设②:该混合金属粉末中除镁外还含有锌元素;
假设③: 。
●实验探究:
甲同学基于假设③设计实验方案如下:

乙同学同样基于假设3设计另一实验方案如下:
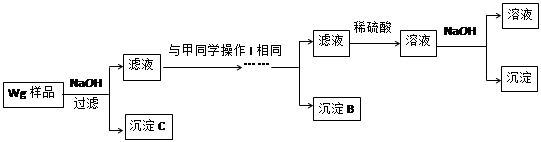
(2)试剂M是________________;沉淀B是 。
(3)丙同学认为乙同学的方案比甲同学的好,理由是 。
(4)丁同学研究了甲、乙两同学的方案后,在其中一种方案的基础上用最简便方法测定了Wg样品中金属镁(Mg)的质量,他的方法是 。
(5)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 。
(6)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图像正确的是__________。
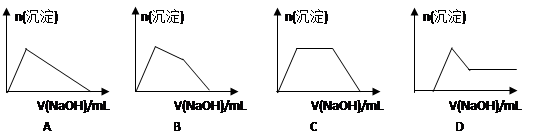
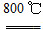 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑