题目内容
 利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应.常用来生产液氨和氨水.完成下列填空:
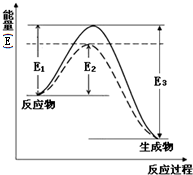
利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应.常用来生产液氨和氨水.完成下列填空:如图表示合成氨时生成1mol生成物时的能量变化,E的单位为kJ.请写出合成氨的热化学方程式
考点:反应热和焓变,热化学方程式
专题:化学反应中的能量变化
分析:△H-生成物能量和-反应物能量和=反应物键能和-生成物键能和=反应物活化能-生成物活化能;催化剂能够降低反应的活化能,据此解答.
解答:
解:据反应图象,先求出反应焓变,△H=反应物活化能-生成物活化能=(E1-E3)KJ/mol,即可写出热化学方程式:N2(g)+3H2(g)?2NH3(g)△H=(E1-E3)kJ/mol;虚线部分和实线相比,只是活化能降低了,反应物和生成物能量相等,所以,虚线部分是使用了催化剂时的能量变化图线,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=(E1-E3)kJ/mol;催化剂.
故答案为:N2(g)+3H2(g)?2NH3(g)△H=(E1-E3)kJ/mol;催化剂.
点评:本题考查热化学方程式书写、催化剂的催化原理,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
某研究小组利用“钯催化交叉偶联反应”合成了有机物丙,合成路线如下:
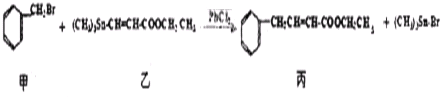
下列分析判断正确的是( )

下列分析判断正确的是( )
| A、分离提纯有机物丙宜在NaOH热溶液中进行 |
| B、利用NaOH溶液、AgNO3溶液即可确定有机物甲中含有溴元素 |
| C、可用酸性KMnO4溶液检验有机物丙中是否含有机物乙 |
| D、PbCl2的作用是提高反应物的活性,加快反应速率 |
若阿伏加德罗常数的值为6.02×1023,则下列叙述正确的是( )
| A、标准状况下,2.24L戊烷中含有2.408×1023个碳碳单键 |
| B、100mL 1mol/L 的Na2CO3溶液中含有6.02×1022个CO32- |
| C、1mol氨气与1mol NH4+中所电子数均为6.02×1024 |
| D、将3.9g Na2O2放入足量的水中,反应时转移6.02×1022个电子 |
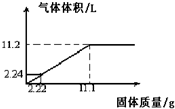 将Mg和Al粉末均匀混合,加入到100mL某浓度的硫酸中,产生氢气的体积(标准状况下)与加入粉末的质量关系如图所示:
将Mg和Al粉末均匀混合,加入到100mL某浓度的硫酸中,产生氢气的体积(标准状况下)与加入粉末的质量关系如图所示: