题目内容
某有机化合物A对氢气的相对密度为29,燃烧该有机物5.8g,生成6.72L二氧化碳气体(标况下)、5.4g水.
(1)求该有机化合物的分子式;
(2)取0.29g该有机化合物与足量银氨溶液反应,析出金属银1.08g.写出该化合物的结构简式.
(1)求该有机化合物的分子式;
(2)取0.29g该有机化合物与足量银氨溶液反应,析出金属银1.08g.写出该化合物的结构简式.
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:(1)有机化合物A对氢气的相对密度为29,则A的相对分子质量=29×2=58,计算二氧化碳、水的物质的量,根据质量守恒判断有机物是否含有氧元素,若有氧元素,计算氧元素质量,进而计算5.8gA中氧原子物质的量,确定有机物A的最简式,再结合相对分子质量确定其分子式;
(2)0.29g该有机物的物质的量=
=0.005mol,与足量银氨溶液反应,析出金属银1.08g,1.08gAg的物质的量=
=0.01mol,有机物A与生成Ag的物质的量之比=0.005mol:0.01mol=1:2,故有机物A分子中含有1个-CHO,结合有机物A的分子式书写其结构简式.
(2)0.29g该有机物的物质的量=
| 0.29g |
| 58g/mol |
| 1.08g |
| 108g/mol |
解答:
解:(1)有机化合物的蒸汽的密度是同条件下氢气的29倍,有机物的相对分子质量=29×2=58,
燃烧该有机物5.8g,生成6.72L二氧化碳气体(标况下)、5.4g水,则二氧化碳物质的量=
=0.3mol,水的物质的量=
=0.3mol,则m(C)+m(H)=0.3mol×12g/mol+0.3mol×2×1g/mol=4.2g<5.8g,故m(O)=5.8g-4.2g=1.6g,n(O)=
=0.1mol,
故有机物A中C、H、O原子数目之比=0.3mol:0.3mol×2:0.1mol=3:6:1,故有机物A的最简式为C3H6O,最简式的相对分子质量为58,而有机物A的相对分子质量为58,故最简式即为A的分子式,故A的分子式为:C3H6O,
答:有机物A的分子式为C3H6O;
(2)0.29g该有机物的物质的量=
=0.005mol,与足量银氨溶液反应,析出金属银1.08g,1.08gAg的物质的量=
=0.01mol,有机物A与生成Ag的物质的量之比=0.005mol:0.01mol=1:2,故有机物A分子中含有1个-CHO,则有机物A的结构简式为:CH3CH2CHO,
答:该有机物A的结构简式为CH3CH2CHO.
燃烧该有机物5.8g,生成6.72L二氧化碳气体(标况下)、5.4g水,则二氧化碳物质的量=
| 6.72L |
| 22.4L/mol |
| 5.4g |
| 18g/mol |
| 1.6g |
| 16g/mol |
故有机物A中C、H、O原子数目之比=0.3mol:0.3mol×2:0.1mol=3:6:1,故有机物A的最简式为C3H6O,最简式的相对分子质量为58,而有机物A的相对分子质量为58,故最简式即为A的分子式,故A的分子式为:C3H6O,
答:有机物A的分子式为C3H6O;
(2)0.29g该有机物的物质的量=
| 0.29g |
| 58g/mol |
| 1.08g |
| 108g/mol |
答:该有机物A的结构简式为CH3CH2CHO.
点评:本题考查有机物分子式确定、醛的性质等,难度不大,注意掌握醛与银氨溶液反应中醛基与Ag的物质的量关系.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
把过量的CO2分别通入下列溶液:①Ca(NO3)2溶液 ②溶有氨的CaCl2溶液 ③苯酚钠的稀溶液 ④溶有大量氨的饱和食盐水,最终能看到白色沉淀的有( )
| A、只有④ | B、②④ |
| C、②③④ | D、①②③④ |
下列说法不正确的是( )
| A、根据物质的导电性,将物质分为导体、半导体和绝缘体 |
| B、复分解反应一定不属于氧化还原反应 |
| C、实验室可用丁达尔效应区分胶体与溶液 |
| D、在水溶液中或熔融状态下能导电的物质叫做电解质 |
下列关于碳酸钠和碳酸氢钠的比较中,不正确的是( )
| A、二者在水中的溶解度不同,碳酸氢钠的溶解度小于碳酸钠 |
| B、二者热稳定性不同,碳酸钠的热稳定性大于碳酸氢钠 |
| C、二者都能与盐酸反应放出二氧化碳气体,等质量时生成CO2量一样多 |
| D、二者在一定条件下可以相互转化 |
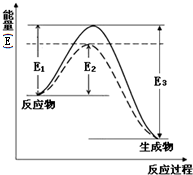 利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应.常用来生产液氨和氨水.完成下列填空:
利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应.常用来生产液氨和氨水.完成下列填空: