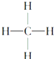��Ŀ����
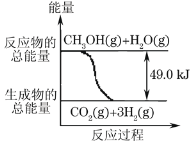
����Ŀ��̼ѭ������ͨ������;����CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) ![]() +49.0kJ�����ݻ�Ϊ2 L���ܱ������г���1 mol CO2��3 mol H2�������ֲ�ͬ��ʵ�������½��з�Ӧ�����CH3OH(g)�����ʵ�����ʱ��仯�����ͼ��ʾ��
+49.0kJ�����ݻ�Ϊ2 L���ܱ������г���1 mol CO2��3 mol H2�������ֲ�ͬ��ʵ�������½��з�Ӧ�����CH3OH(g)�����ʵ�����ʱ��仯�����ͼ��ʾ��
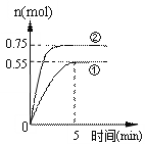
��1��ǰ5 min��ʵ��ٵ�ƽ����Ӧ����v(H2)=_____mol/(Lmin)��
��2����˵��������Ӧ�ﵽƽ��״̬����_________�����ţ���
a����������ƽ����Է�����������ʱ��仯���仯
b����λʱ����ÿ����3 mol H2��ͬʱ����1 mol H2O
c��CO2����������ڻ�������б��ֲ���
d��v��(CO2) =3v��(H2)
��3�������ȣ��ڽ��ı�һ�ַ�Ӧ���������ı��������____________���жϵ�����_______________________________________________________��
��4����һ���¶��£���2.0 LCO2��6.0 LH2ͨ��һ��������������ɱ���ܱ������У�������һ���������ͨ����Ӧ�ﵽƽ���û������Ϊ7.0 L���������ƽ���������Ϊ6.5 L����ɲ�ȡ�Ĵ�ʩ��_____����ʹ��Ӧ��K��С�����Բ�ȡ�Ĵ�ʩ��_____��
���𰸡�0.165 ac ����ѹǿ ��Ϊ�����ȣ��ڵķ�Ӧ��������ƽ�������ƶ�����������ѹǿ����� ���� ���¡�
��������
��1����������ʽ��
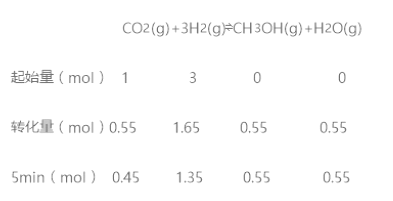
�ӷ�Ӧ��ʼ��ƽ��,������ƽ����Ӧ����v(H2)=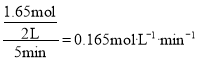 ���ʴ�Ϊ��0.165��
���ʴ�Ϊ��0.165��
��2��a. �÷�Ӧǰ����������������ı䣬��������ƽ����Է�����������ʱ��仯���仯�������淴Ӧ����ƽ�⣬a��ȷ��
b. ��λʱ����ÿ����3molH2��ͬʱ����1molH2O������ʾ����Ӧ���ʣ�����˵�����淴Ӧ����ƽ�⣬b����
c. CO2����������ڻ�������б��ֲ��䣬˵�����淴Ӧ����ƽ�⣬c��ȷ��
d. ���� v��(CO2) =3v��(H2)����3v��(CO2)=v��(H2)����ʽ�ӱ�ʾ�Ķ��Ƿ�Ӧ������ʣ��ҵ��ڼ�����֮�ȣ���Ӧ���ܴ�û�ﵽƽ��״̬�����ڸõ�ʽ��ϵ˵������ƽ�⣬d���ʴ�Ϊ��ac��
��3���ڱȢٸ���ﵽƽ�⣬�������ȣ��ﵽƽ��ʱ���״���Ũ�Ƚϴ�˵�������ȣ��ڵ�ƽ�������ƶ�����ı�������ǣ���ѹ��ԭ���ǣ���Ϊ�����ȣ��ڵķ�Ӧ��������ƽ�������ƶ�����������ѹǿ����������������£�����ƽ�������ƶ�����ͼ�����ʴ�Ϊ������ѹǿ����Ϊ�����ȣ��ڵķ�Ӧ��������ƽ�������ƶ�����������ѹǿ�������
��4��CO2(g)+3H2(g)CH3OH(g)+H2O(g) ![]() +49.0kJ���÷�ӦΪ����Ӧ���ȵķ�Ӧ���ҷ�Ӧǰ�������С�ķ�Ӧ����Ӧ�ﵽƽ���û������Ϊ7.0 L���������ƽ���������Ϊ6.5 L����ɲ�ȡ�Ĵ�ʩ�ǽ��£���ʹ��Ӧ��K��С����ƽ�������ƶ�������Բ�ȡ�Ĵ�ʩ�����£��ʴ�Ϊ�����£����¡�
+49.0kJ���÷�ӦΪ����Ӧ���ȵķ�Ӧ���ҷ�Ӧǰ�������С�ķ�Ӧ����Ӧ�ﵽƽ���û������Ϊ7.0 L���������ƽ���������Ϊ6.5 L����ɲ�ȡ�Ĵ�ʩ�ǽ��£���ʹ��Ӧ��K��С����ƽ�������ƶ�������Բ�ȡ�Ĵ�ʩ�����£��ʴ�Ϊ�����£����¡�

����Ŀ���ж����и�������������𣬲�����Ӧ�����������С�
��![]() ��
��![]() ��
��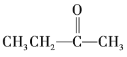 ��
�� ��
�� ��
�� ��
�� ��
��![]() ��
��![]() ��
��![]()
![]()
![]()
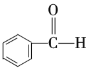
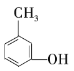
���� | ������ | ±���� | �� | �� | ȩ | ͪ | ���� | �� |
���� | ________ | _________ | ________ | _________ | _________ | ________ | p>________ | ________ |
����Ŀ����ˮ���Ȼ�����SnCl4���������л��ϳɵ��Ȼ�������ʵ���ҿ������������������Ʊ���SnCl4�ӷ���������ˮ�⣬Cl2��������SnCl4���Ʊ�ԭ����ʵ��װ����ͼ��ʾ��
Sn(s)+2Cl2(g)=SnCl4(l) ��H=�C511kJmol��1

�����õ����й��������£�
���� | Sn | SnCl4 | CuCl2 |
�۵�/�� | 232 | -33 | 620 |
�е�/�� | 2260 | 114 | 993 |
�Ʊ������У����������ģ�������������ʱ��Ӧ���в�����������SnCl4Һ��������ڸ߶�ʱ��Һ̬���ᆳ����������ƿ���ش��������⣺
��1��Sn�����ڱ��е�λ��Ϊ_______________
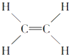
��2��a�ܵ�������_______________��A�з�Ӧ�����ӷ���ʽ��______________��
��3��װ��D��������________________��װ��E����ȴˮ��������___________��
��4������Sn��֮ǰҪ����������������װ�ã���Ŀ����___________________��
��5�������к�ͭ������E�в���CuCl2������Ӱ��F�в�Ʒ�Ĵ��ȣ�ԭ����________��ʵ������SnCl4���ܽ���Cl2�����Ի�ɫ���ᴿSnCl4�ķ�����____(�����)��
a.��NaOH��Һϴ�������� b.���� c.���� d.����
��6��β������ʱ����ѡ�õ�װ����________������ţ���

��7��SnCl4�ڿ�������ˮ������Ӧ�����ɰ�ɫSnO2��xH2O���壬�����Կ���������������ѧ����ʽΪ___________________________________��