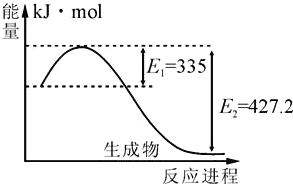
��Ŀ����
����Ŀ��A��B��C��D��E��F����Ԫ�ؾ�λ�����ڱ���ǰ�����ڣ���ԭ��������������Ԫ��A��ԭ�Ӱ뾶��С��Ԫ�أ�BԪ�ػ�̬ԭ�ӵĺ�����ӷ�ռ�ĸ�ԭ�ӹ����DԪ��ԭ�ӵ��ѳɶԵ���������δ�ɶԵ���������3����E��D����ͬһ���壻Fλ��ds������ԭ�ӵ������ֻ��1�����ӡ�
��F+���ӵĵ����Ų�ʽ��______��
��B��C��DԪ�صĵ�һ�������ɴ�С��˳����______��
��B��CԪ�ص�ijЩ�⻯��ķ����о�����18�����ӣ���B�������⻯��Ļ�ѧʽ��______��B��C����Щ�⻯��ķе����ϴ����Ҫԭ����______��
��A��B��D���γɷ���ʽΪA2BD��ij�������û����������Bԭ�ӵĹ���ӻ�������______��1mol�÷����к���![]() ������Ŀ��______��
������Ŀ��______��
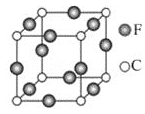
��C��F��Ԫ���γɵ�ij������ľ����ṹ��ͼ��ʾ����û�����Ļ�ѧʽ��______��Cԭ�ӵ���λ����______��
���𰸡�1s22s22p63s23p63d10��[Ar]3d10 N > O > C C2H6 �����⻯��(N2H4)���Ӽ������� sp2 NA Cu3N 6
��������
A��B��C��D��E��F����Ԫ�ؾ�λ�����ڱ���ǰ�����ڣ���ԭ��������������Ԫ��A��ԭ�Ӱ뾶��С��Ԫ�أ���A��HԪ�أ�BԪ�ػ�̬ԭ�ӵĺ�����ӷ�ռ�ĸ�ԭ�ӹ������BΪCԪ�أ�DԪ��ԭ�ӵ��ѳɶԵ���������δ�ɶԵ���������3������D��OԪ�أ�CԪ��ԭ����������B��С��D����C��NԪ�أ�E��D����ͬһ���壬��E��SԪ�أ�Fλ��ds������ԭ�ӵ������ֻ��1�����ӣ���FΪCuԪ�أ�
��Cu+��Cuԭ��ʧȥ�������ӵõ������ӣ������Ӻ�����28�����ӣ����ݹ���ԭ����д��ͭ���Ӻ�������Ų�ʽΪ1s22s22p63s23p63d10��[Ar]3d10���ʴ�Ϊ��1s22s22p63s23p63d10��[Ar]3d10��
��B��C��D�ֱ���C��N��OԪ�أ���λ��ͬһ���ڣ�ͬһ����Ԫ�ص�һ����������ԭ��������������������ƣ�����IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ�أ�����������Ԫ�ص�һ�����ܴ�С˳����N > O > C���ʴ�Ϊ��N > O > C��
��C��NԪ�ص�ijЩ�⻯��ķ����о�����18�����ӣ���B�������⻯��ΪC2H6������������⻯���۷е�ϸߣ�N2H4�к��������C2H6�в�����������Ե����⻯���۷е�ϸߣ��ʴ�Ϊ��C2H6�������⻯��N2H4���Ӽ���������
��H��C��O���γɷ���ʽΪH2CO��ij�����ΪHCHO���÷�����Cԭ�Ӽ۲���ӶԸ�����3�Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж�Cԭ���ӻ���ʽΪsp2��һ����ȩ�����к���1����������1mol��ȩ�к���1mol��������ĿΪNA���ʴ�Ϊ��sp2��NA��
��N��Cu��Ԫ���γɵ�ij������ľ����ṹ��ͼ��ʾ���þ�����Cuԭ�Ӹ���![]() ��Nԭ�Ӹ���
��Nԭ�Ӹ���![]() �������仯ѧʽΪCu3N���þ�����Nԭ����λ��Ϊ6���ʴ�Ϊ��Cu3N��6��
�������仯ѧʽΪCu3N���þ�����Nԭ����λ��Ϊ6���ʴ�Ϊ��Cu3N��6��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ������ʵ������ܴﵽ��Ӧʵ��Ŀ�ĵ���
ѡ�� | ʵ��Ŀ�� | ʵ����� |
A | ̽��I-��Fe2+�Ļ�ԭ��ǿ�� | ��FeCl3ϡ��Һ�����μ���KI��Һ������ |
B | ̽��HPO42-��ˮ��Һ�еĵ���̶���ˮ��̶ȵ���Դ�С | �ⶨ0.1 mol��L-1NaH2PO4��Һ��pH |
C | ����0.1 mol��L-1�ڱ����������( | ��ȡ5.1 g�ڱ�������������ձ���,������������ˮ�ܽ�,ת����500 mL����ƿ�ж��� |
D | �Ƚ�CaCO3��CaSO4��Ksp��С | �����ʯ��ˮ�е���0.1 mol��L-1Na2CO3��Һ�������г�������,�ٵμ�0.1 mol��L-1Na2SO4��Һ |
A.AB.BC.CD.D