题目内容
2.X是短周期中原子半径最小的元素,X、Y组成的气体甲能使湿润的红色石蕊试纸变蓝;(1)Y的原子结构示意图是
 .
.(2)甲的水溶液与硫酸铝溶液反应离子方程式3NH3?H20+Al3+=Al(OH)3↓+3NH4+.
(3)甲与氯化氢反应生成乙.乙所含化学键类型有离子键和共价键.在0.1mol•L-1乙溶液中,所含离子浓度由大到小的顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-).
(4)工业上,可通过如下转化制得尿素晶体:N2$→_{Ⅰ}^{高温高压催化剂,H_{2}}$NH3$?_{Ⅱ}^{CO_{2}}$CO(NH2)2气体$→_{Ⅲ}^{冷凝结晶}$尿素
①Ⅰ中恒温恒容条件下,能同时提高化学反应速率和NH3产率的是增大压强.
②反应Ⅱ:2NH3(g)+CO2(g)?CO(NH2)2(g)+H2O(g)△H1=-536.1kJ•mol-1
(i)此反应的平衡常数表达式K=$\frac{c[CO(N{H}_{2})_{2}]×c({H}_{2}O)}{{c}^{2}(N{H}_{3})×c(C{O}_{2})}$.升高温度,K值减小(填增大、减小或不变).
(ii)尿素可用于处理汽车尾气.CO(NH2)2(g)与尾气中NO反应生成CO2、N2、H2O(g)排出.
已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H2=-1806.4kJ•mol-1
写出CO(NH2)2(g)与NO反应的热化学方程式2CO(NH2)2(g)+6NO(g)=2CO2(g)+5N2(g)+4H2O(g)△H=-734.2kJ/mol.
分析 X是短周期中原子半径最小的元素,是氢元素,X、Y组成的气体甲能使湿润的红色石蕊试纸变蓝,则甲为氨气,则Y是N元素;
(1)N的原子结构示意图是 ;
;
(2)氨气的水溶液与硫酸铝溶液反应离子方程式3NH3?H20+Al3+=Al(OH)3↓+3NH4+;
(3)氨气与氯化氢反应生成氯化铵,氯化铵中所含化学键类型有铵根离子与氯离子之间形成的离子键和氮与氢之间形成的共价键;氯化铵是强酸弱碱盐水解呈酸性,离子浓度大小:不水解的离子>水解的弱离子>显性离子>隐性离子;
(4)①合成氨的反应是体积减少的反应,所以可以通过增大压强,加快化学反应的速率,提高氨气的转化率;
②(i)平衡常数等于平衡时生成物的浓度幂之积比上反应物浓度幂之积,正反应是放热反应,温度越高K值越小;
(ii)依据热化学方程式和盖斯定律计算得到所需热化学方程式.
解答 解:(1)N的原子结构示意图是 ,故答案为:
,故答案为: ;
;
(2)氨气的水溶液与硫酸铝溶液反应离子方程式3NH3?H20+Al3+=Al(OH)3↓+3NH4+,故答案为:3NH3?H20+Al3+=Al(OH)3↓+3NH4+;
(3)氨气与氯化氢反应生成氯化铵,氯化铵中所含化学键类型有铵根离子与氯离子之间形成的离子键和氮与氢之间形成的共价键;氯化铵是强酸弱碱盐水解呈酸性,离子浓度大小:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故答案为:离子键和共价键;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(4)①合成氨的反应是体积减少的反应,所以可以通过增大压强,加快化学反应的速率,提高氨气的转化率,故答案为:增大压强;
②平衡常数等于平衡时生成物的浓度幂之积比上反应物浓度幂之积,所以K=$\frac{c[CO(N{H}_{2})_{2}]×c({H}_{2}O)}{{c}^{2}(N{H}_{3})×c(C{O}_{2})}$,正反应是放热反应,温度越高K值越小,
故答案为:$\frac{c[CO(N{H}_{2})_{2}]×c({H}_{2}O)}{{c}^{2}(N{H}_{3})×c(C{O}_{2})}$;减小;
(ii)①2NH3(g)+CO2(g)?CO(NH2)2(g)+H2O(g)△H1=-536.1kJ•mol-1,
②4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H2=-1806.4kJ•mol-1
依据盖斯定律②-①×2得到CO(NH2)2(g)与NO反应的热化学方程式2CO(NH2)2(g)+6NO(g)=2CO2(g)+5N2(g)+4H2O(g)△H=-734.2 kJ/mol;
故答案为:2CO(NH2)2(g)+6NO(g)=2CO2(g)+5N2(g)+4H2O(g)△H=-734.2 kJ/mol.
点评 本题考查了原子结构、离子方程的书写,化学平衡、反应速率影响因素分析,化学平衡常数表达式,掌握基础是关键,题目难度中等.

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案| A. | 166 | B. | 99 | C. | 67 | D. | 32 |
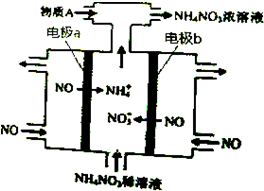
| A. | b极的电极反应为:NO-3e-+2H2O=NO3-+4H+ | |
| B. | 溶液中的H+由电极a处向电极b处迁移 | |
| C. | 电解过程总反应的化学方程式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3 | |
| D. | 为使电解产物全部转化为NH4NO3,需补充的物质A是NH3 |
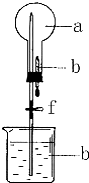 如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与试验事实不相符的是( )
如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与试验事实不相符的是( )| A. | CO2(NaHCO3溶液)无色喷泉 | B. | NH3(H2O含酚酞)红色喷泉 | ||
| C. | Cl2(NaOH溶液)无色喷泉 | D. | HCl(AgNO3溶液)白色喷泉 |
| A. | 标准状况下,22.4 L二氯甲烷的分子数约为NA个 | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol | |
| C. | 17.6 g丙烷中所含的极性共价键为6.4 NA个 | |
| D. | 电解精炼铜时,若阴极得到的电子数为2 NA个,则阳极质量减少64 g |

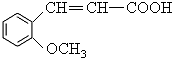 .
.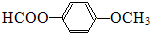 、
、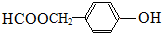 或
或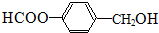 (任写一种).
(任写一种).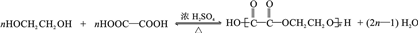 .
.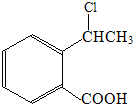 为原料制
为原料制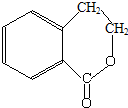 的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如图2:
的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如图2: ,D中官能团的名称为羧基.
,D中官能团的名称为羧基. 2CH3CHO+2H2O.
2CH3CHO+2H2O. CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.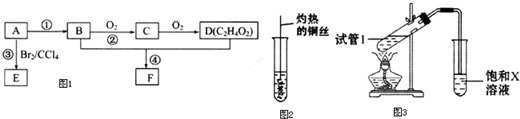
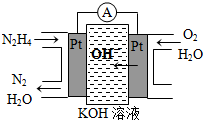 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题