题目内容
【题目】铁矿石主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。有一种测定铁矿石中含铁量的方法如下。已知:2Na2S2O3+I2→Na2S4O6+2NaI。完成下列填空:
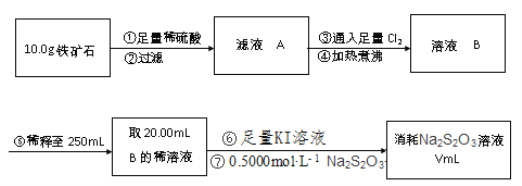
(1)步骤②用到的玻璃仪器除烧杯外,还有______。
(2)步骤③对应反应的离子方程式为______。
(3)步骤④中煮沸的作用是______。步骤⑤中必须用到的定量实验仪器是______。
(4)步骤⑦可用淀粉作为滴定终点的指示剂,达到滴定终点时的现象是______。若滴定过程中有空气进入,则测定结果______(选填“偏高”、“偏低”或“无影响”。
(5)若过程⑦中消耗0.5000mol/LNa2S2O3溶液20.00mL,则铁矿石中铁的百分含量为______。
【答案】漏斗、玻璃棒2Fe2++Cl2=2Fe3++2Cl-除去过量的氯气,避免影响后续滴定250mL容量瓶溶液由蓝色恰好变为无色且30秒内不还原偏高70%
【解析】
(1)步骤②操作方法是过滤,用到的玻璃仪器时烧杯、玻璃棒、(普通)漏斗;
(2)铁矿石中含有铁的氧化物,杂质不含铁元素和氧元素,加入稀硫酸,铁的氧化物与稀硫酸发生反应,滤液A中有含铁元素的离子,通入足量氯气的目的是把溶液中Fe2+氧化成Fe3+,即离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(3)步骤③中通入过量的氯气,过量的氯气能与Na2S2O3发生反应,因此加热煮沸的目的是除去过量的氯气,避免对后续实验产生干扰;步骤⑤稀释至250mL溶液,这需要在容量瓶中进行操作,即步骤⑤必须用到的定量实验仪器是250mL容量瓶;
(4)加入足量的KI溶液,发生2Fe3++2I-=2Fe2++I2,向此溶液中滴加淀粉溶液,溶液变蓝,然后滴加Na2S2O3溶液消耗I2,因此滴定终点的现象是溶液由蓝色恰好变为无色且30秒内不还原;空气中氧气能把I-氧化成I2,使消耗的Na2S2O3的量增加,即所测结果偏高;
(5)根据反应的方程式可知2Fe3+~2I-~2Na2S2O3,矿石中铁元素的百分含量=![]() =70%。
=70%。

【题目】某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,工艺流程如下:
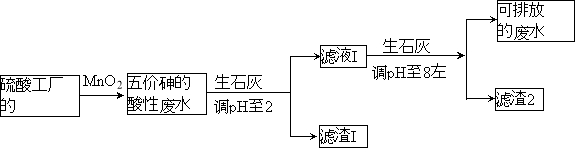
相关数据如下表,请回答以下问题:
表1.几种盐的Ksp
难溶物 | Ksp |
Ca3(AsO4)2 | 6.8×10-19 |
CaSO4 | 9.1×10-6 |
FeAsO4 | 5.7×10-21 |
表2.工厂污染物排放浓度及允许排放标准
污染物 | H2SO4 | As |
废水浓度 | 29.4g/L | 1.6g·L-1 |
排放标准 | pH 6~9 | 0.5mg·L-1 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= mol·L-1。
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol·L-1,c(AsO43-)= mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为
。
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 K2=1.7×10-7 K3=4.0×10-12,第三步电离的平衡常数的表达式为K3= 。Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O![]() HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+ H2O(g)![]() CO2 (g)+ H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
CO2 (g)+ H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A. 反应在t1min内的平均速率为![]()
B. 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时n(CO2)= 0.40mol
C. 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时H2O转化率增大
D. 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
【题目】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为C(s)+H2O(g)CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。
①该反应在常温下_______(填“能”或“不能”)自发进行。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是____(填字母,下同)。
a.容器中的压强不变
b.1 mol H—H键断裂的同时,断裂2 mol H—O键
c.c(CO)=c(H2)
d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中从反应开始至平衡以CO2表示的平均反应速率为v(CO2)=________(取小数点后两位,下同)。
②该反应的正反应为________(
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,达到平衡后下列措施中能使c(CH3OH)增大的是________。

a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2


