题目内容
【题目】下图是利用废铜屑(含杂质)制备胆矾(硫酸铜晶体)的过程
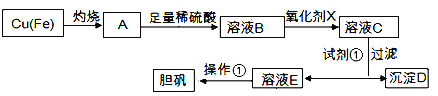
已知:
溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
完全生成氢氧化物的沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
请回答:
(1)下列物质中最适宜做氧化剂X的是________(填字母)。
A. NaClO B. H2O2 C.KMnO4
(2)加入试剂①是为了调节pH,试剂①可以选择________(填化学式)。
(3)操作①的名称是________。
(4)沉淀D加入盐酸可以得到FeCl3溶液,关于FeCl3溶液的性质中说法不正确的是________。
A. 将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B. 向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
C. 将FeCl3溶液滴加NaOH溶液,将沉淀干燥灼烧,得到Fe(OH)3固体
D. 向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(5) 沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,其原因是________________(用离子方程式表示)。
【答案】 B CuO或CuCO3或Cu(OH)2 蒸发结晶 C Fe+2Fe3+=3Fe2+
【解析】试题分析:(1)次氯酸钠、过氧化氢、高锰酸钾均可氧化亚铁离子为铁离子,但次氯酸钠、高锰酸钾做氧化剂时,会产生其他杂质,而过氧化氢做氧化剂,只被还原为水,不会引入新的杂质,所以答案选B;
(2)加入试剂①,调节溶液的pH,目的是时铁离子沉淀,所以加入的试剂为铜试剂,可与硫酸反应生成硫酸铜,则可以是CuO或CuCO3或Cu(OH)2中的一种;
(3)从溶液中得到晶体的操作为蒸发浓缩,冷却结晶,过滤;
(4)A、沸水中加入饱和氯化铁溶液,加热至溶液为红褐色时,可得到氢氧化铁胶体,可产生丁达尔效应,A正确;B、氯化铁与氢氧化钠溶液反应生成氢氧化铁沉淀,B正确;C、氯化铁与氢氧化钠溶液反应生成氢氧化铁沉淀,将氢氧化铁干燥灼烧后得到氧化铁固体,因为氢氧化铁受热分解生成氧化铁和水,C错误;D、铁离子与KSCN溶液反应生成血红色的络合物,溶液变红色,D正确,答案选C;
(5)沉淀D是氢氧化铁,与盐酸反应生成氯化铁和水,氯化铁与铁反应生成氯化亚铁,所以实验室保存FeCl2溶液时,加入铁粉,目的是防止亚铁离子被氧化,离子方程式是Fe+2Fe3+=3Fe2+。

【题目】某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,工艺流程如下:
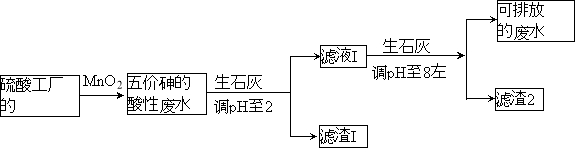
相关数据如下表,请回答以下问题:
表1.几种盐的Ksp
难溶物 | Ksp |
Ca3(AsO4)2 | 6.8×10-19 |
CaSO4 | 9.1×10-6 |
FeAsO4 | 5.7×10-21 |
表2.工厂污染物排放浓度及允许排放标准
污染物 | H2SO4 | As |
废水浓度 | 29.4g/L | 1.6g·L-1 |
排放标准 | pH 6~9 | 0.5mg·L-1 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= mol·L-1。
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol·L-1,c(AsO43-)= mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为
。
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 K2=1.7×10-7 K3=4.0×10-12,第三步电离的平衡常数的表达式为K3= 。Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O![]() HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。

