题目内容
【题目】磷是重要的元素,能形成多种含氧酸。回答下列问题:
(1)次磷酸(H3PO2)是一元酸,其电离常数的值K=9×103。向10mL0.1 molL-1H3PO2溶液中加入30mL等物质的量浓度的NaOH溶液,写出反应的离子方程式_________,c(Na+)+(H2PO2-)+c(H3PO2)=______(忽略混合后溶波体积的变化)。
(2)亚磷酸(H3PO3)是二元弱酸, 25℃时亚磷酸的电离常数的值为K1=1×10-2、k2=2.6×10-7,则NaH2PO3溶液显性_____(填“酸”“碱”或“中”),原因是____(结合化学用语及数据计算进行解释)
(3)已知HF的电离常数的值为K=3.6×10-4,将足量HF溶液和Na2HPO3溶液反应,其离子方程式为______。
(4)亚磷酸具有强还原性。化学实验小组利用滴定法测定某亚磷酸溶液的浓度,取25.00mL的亚磷酸溶液放入锥形瓶中,用0.10 molL-1的高锰酸钾溶液进行滴定,反应的离子方程式是5H3PO3+ 2MnO4-+6H+ = 5H3PO4+ 2Mn2+ +3H2O。
三次滴定实验的数据分别如下:
实验编号 | 滴定前读数 | 滴定后读数 |
1 | 0.50 | 22.50 |
2 | 1.50 | 24.50 |
3 | 1.00 | 22.00 |
①亚磷酸溶液的物质的量浓度为______。
②关于该实验下列说法正确的是______(填写序号)。
a 取亚磷酸溶液的滴定管,洗涤后未润洗,导致结果偏低
b 盛高锰酸钾溶液的滴定管滴定前有气泡,滴定后无气泡,导致结果偏高
c 滴定过程中眼睛只注视滴定管中液面变化,并做好记录
d 锥形瓶未干燥底部有水,会导致结果偏低
【答案】H3PO2+OH-= H2PO2-+H2O 0.1mol/L 酸 H2PO3-溶液中存在水解平衡和电离平衡:H2PO3-+H2O![]() H3PO3+OH-、H2PO3-
H3PO3+OH-、H2PO3-![]() HPO32-+H+,水解平衡常数为:Kh=
HPO32-+H+,水解平衡常数为:Kh=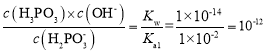 <K2=2.6×10-7,即电离大于水解,所以NaH2PO3溶液显酸性 HPO32-+HF=H2PO3-+F- 0.22mol/L ab
<K2=2.6×10-7,即电离大于水解,所以NaH2PO3溶液显酸性 HPO32-+HF=H2PO3-+F- 0.22mol/L ab
【解析】
(1)由于次磷酸(H3PO2)是一元酸,向10 mL 0.1 molL-1 H3PO2溶液中加入30 mL等物质的量浓度的NaOH溶液,则NaOH溶液过量,反应的离子方程式为:H3PO2+OH-=H2PO2-+H2O;根据元素守恒:c(Na+)+c(H2PO2-)+c(H3PO2)=![]() =0.1mol/L;
=0.1mol/L;
(2)由于H2PO3-溶液中存在水解平衡和电离平衡:H2PO3-+H2O![]() H3PO3+OH-、H2PO3-
H3PO3+OH-、H2PO3-![]() HPO32-+H+,水解平衡常数为:Kh=
HPO32-+H+,水解平衡常数为:Kh=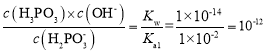 <K2=2.6×10-7,即电离大于水解,所以NaH2PO3溶液显酸性;
<K2=2.6×10-7,即电离大于水解,所以NaH2PO3溶液显酸性;
(3)因为亚磷酸的电离常数的值为K1=1×10-2、K2=2.6×10-7,HF的电离常数的值为K=3.6×10-4,则酸性强弱为:H3PO3>HF>H2PO3-,根据强酸制弱酸书写离子方程式为:HF+HPO32-=H2PO3-+F-;
(4)①高锰酸钾溶液滴定亚磷酸溶液,离子方程式是5H3PO3+2MnO4-+6H+=5H3PO4+2Mn2++3H2O,实验1:V1=22.5 mL -0.5 mL =22mL,实验2:V2=24.5 mL -1.5 mL =23mL,实验3:V3=22 mL -1 mL =21mL,所以平均体积V=![]() =22mL,根据5H3PO3~2MnO4-,则c(H3PO3)=
=22mL,根据5H3PO3~2MnO4-,则c(H3PO3)=![]() =0.22mol/L;
=0.22mol/L;
②a. 亚磷酸溶液的滴定管洗涤后未润洗,则待测液被稀释,浓度降低,故a正确;
b. 滴定管滴定前有气泡,滴定后无气泡,则V标偏大,导致结果偏大,故b正确;
c. 滴定过程中,眼睛注视锥形瓶中颜色的变化,故c错误;
d. 锥形瓶盛放待测液,锥形瓶未干燥底部有水,待测液浓度降低,但待测液物质的量不变,消耗标准液体积不变,测定结果不变,故d错误;故答案为:ab。