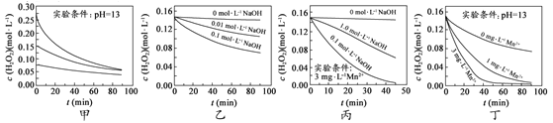
题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24 L SO3中含原子数为0.2NA
B.10 mL 12 mol/L 浓盐酸与足量MnO2加热反应,制得氯气的分子数0.03NA
C.0.1 mol CH4与0.4 mol Cl2在光照下充分反应,生成CCl4的分子数为0.1NA
D.常温常压下,6 g乙酸中C-H键的数目为0.3NA
【答案】D
【解析】
A. 在标准状况下SO3不是气体,不能使用气体摩尔体积计算,A错误;
B. 10 mL 12 mol/L 浓盐酸中HCl的物质的量为n(HCl)=c·V=12 mol/L×0.01 L=0.12 mol,根据反应方程式MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O可知:4 mol HCl完全反应产生1 mol Cl2,若0.12 molHCl完全反应产生Cl2的物质的量是0.03 mol,但随着反应的进行,溶液变稀,反应就不再发生,所以制取氯气的物质的量小于0.03 mol,则反应产生的氯气的分子数小于0.03NA,B错误;
MnCl2+Cl2↑+2H2O可知:4 mol HCl完全反应产生1 mol Cl2,若0.12 molHCl完全反应产生Cl2的物质的量是0.03 mol,但随着反应的进行,溶液变稀,反应就不再发生,所以制取氯气的物质的量小于0.03 mol,则反应产生的氯气的分子数小于0.03NA,B错误;
C. 取代反应逐步进行,最终会得到CH3Cl、CH2Cl2、CHCl3、CCl4多种取代产物,所以0.1 mol CH4与0.4 mol Cl2在光照下充分反应,生成CCl4的分子数小于0.1NA,C错误;
D. 6 g乙酸的物质的量为n(乙酸)=![]() =0.1 mol,根据其结构简式CH3COOH可知分子中含有3个C-H键,所以0.1 mol乙酸中含有0.3 molC-H键,C-H键数目为0.3NA,D正确;
=0.1 mol,根据其结构简式CH3COOH可知分子中含有3个C-H键,所以0.1 mol乙酸中含有0.3 molC-H键,C-H键数目为0.3NA,D正确;
故合理选项是D。

 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】磷是重要的元素,能形成多种含氧酸。回答下列问题:
(1)次磷酸(H3PO2)是一元酸,其电离常数的值K=9×103。向10mL0.1 molL-1H3PO2溶液中加入30mL等物质的量浓度的NaOH溶液,写出反应的离子方程式_________,c(Na+)+(H2PO2-)+c(H3PO2)=______(忽略混合后溶波体积的变化)。
(2)亚磷酸(H3PO3)是二元弱酸, 25℃时亚磷酸的电离常数的值为K1=1×10-2、k2=2.6×10-7,则NaH2PO3溶液显性_____(填“酸”“碱”或“中”),原因是____(结合化学用语及数据计算进行解释)
(3)已知HF的电离常数的值为K=3.6×10-4,将足量HF溶液和Na2HPO3溶液反应,其离子方程式为______。
(4)亚磷酸具有强还原性。化学实验小组利用滴定法测定某亚磷酸溶液的浓度,取25.00mL的亚磷酸溶液放入锥形瓶中,用0.10 molL-1的高锰酸钾溶液进行滴定,反应的离子方程式是5H3PO3+ 2MnO4-+6H+ = 5H3PO4+ 2Mn2+ +3H2O。
三次滴定实验的数据分别如下:
实验编号 | 滴定前读数 | 滴定后读数 |
1 | 0.50 | 22.50 |
2 | 1.50 | 24.50 |
3 | 1.00 | 22.00 |
①亚磷酸溶液的物质的量浓度为______。
②关于该实验下列说法正确的是______(填写序号)。
a 取亚磷酸溶液的滴定管,洗涤后未润洗,导致结果偏低
b 盛高锰酸钾溶液的滴定管滴定前有气泡,滴定后无气泡,导致结果偏高
c 滴定过程中眼睛只注视滴定管中液面变化,并做好记录
d 锥形瓶未干燥底部有水,会导致结果偏低