题目内容
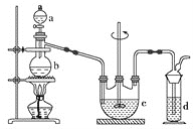
【题目】某同学为改进金属钠与氯气反应的实验,设计了如下装置。
![]()
可供选择的试剂有:金属钠、MnO2、KClO3固体、盐酸、NaOH溶液、澄清石灰水。
(1)玻璃仪器C的名称是____。
(2)针筒A中放的是盐酸,则B中放的是____。
(3)针筒D的作用是____。
【答案】球形干燥管 KClO3固体 吸收过量的氯气,防止污染环境
【解析】
进行金属钠与氯气反应的实验,针筒A中盛放的是浓盐酸,则B中为KClO3固体,发生KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,球形干燥管C中发生Na与氯气的反应生成NaCl,D中NaOH吸收尾气,以此解答该题。
(1)由装置可知C的名称是球形干燥管;
(2)针筒A中放的是盐酸,应在B中反应生成氯气,且在常温下生成氯气,只有KClO3固体符合;
(3)针筒D中盛放的试剂是NaOH溶液,作用是吸收过量的氯气,防止污染环境。

【题目】(1)已知:常温下浓度为0.1mol/L的下列溶液的pH如表
溶质 | NaCl | CH3COOK | Na2CO3 | NaClO | NaHCO3 |
pH | 7 | 8.1 | 11.6 | 9.7 | 8.3 |
①等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl-和ClO-离子个数:Cl-_________ClO-,浓度相等的NaClO和CH3COOK溶液中:[c(Na+)-c(ClO-)]__________[c(K+)-c(CH3COO-)](填“>”“<”或“=”)
②HCO3-的水解常数为__________(填写具体数值),在相同温度下,同浓度的CH3COOH、H2CO3、HClO三种酸溶液的导电能力大小为__________
(2)常温下,向pH=a的醋酸中加入等体积NaOH时后呈中性,则此NaOH的pH_____14-a(>、<、=)
(3)常温下,已知0.1mol﹒L-1一元酸HA溶液中![]() =1×10-6。
=1×10-6。
①常温下,0.1mol﹒L-1HA溶液的pH=_____;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:_____。
(4)常温下,amol/L氨水与等体积0.1mol/LH2SO4溶液混合后溶液显中性,则NH3·H2O的电离平衡常数Kb=_____