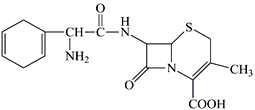
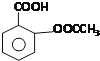
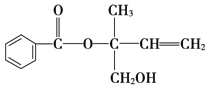
题目内容
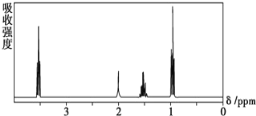
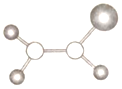
【题目】如图是某种有机物分子的球棍模型。图中的“棍”代表单键或双键,不同大小的“球”代表三种不同的短周期元素的原子。对该有机物的叙述错误的是( )
A.该有机物的分子式可能为![]()
B.该有机物分子中的所有原子在同一平面上
C.该有机物无相同官能团同分异构体
D.该有机物可以和氢气发生加成反应
【答案】A
【解析】
根据图中“棍”代表单键或双键或三键,不同大小的球代表不同元素的原子,且三种元素位于不同的短周期,由图可知,含类似乙烯的结构,存在C=C,由C、H、Cl元素组成,以此解答该题。
A.含有2个C原子,分子式可能为C2H3Cl,故A错误;
B.含有碳碳双键,具有乙烯的结构特点,则所有原子在同一平面上,故B正确;
C.含有碳碳双键,对应一氯代物只有一种,故C正确;
D.含有碳碳双键,可与氢气发生加成反应,故D正确。
故选:A。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】(1)已知:常温下浓度为0.1mol/L的下列溶液的pH如表
溶质 | NaCl | CH3COOK | Na2CO3 | NaClO | NaHCO3 |
pH | 7 | 8.1 | 11.6 | 9.7 | 8.3 |
①等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl-和ClO-离子个数:Cl-_________ClO-,浓度相等的NaClO和CH3COOK溶液中:[c(Na+)-c(ClO-)]__________[c(K+)-c(CH3COO-)](填“>”“<”或“=”)
②HCO3-的水解常数为__________(填写具体数值),在相同温度下,同浓度的CH3COOH、H2CO3、HClO三种酸溶液的导电能力大小为__________
(2)常温下,向pH=a的醋酸中加入等体积NaOH时后呈中性,则此NaOH的pH_____14-a(>、<、=)
(3)常温下,已知0.1mol﹒L-1一元酸HA溶液中![]() =1×10-6。
=1×10-6。
①常温下,0.1mol﹒L-1HA溶液的pH=_____;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:_____。
(4)常温下,amol/L氨水与等体积0.1mol/LH2SO4溶液混合后溶液显中性,则NH3·H2O的电离平衡常数Kb=_____