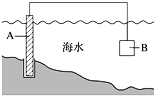
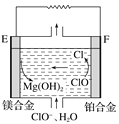
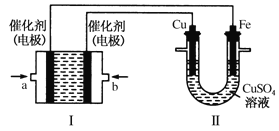
题目内容
【题目】(1)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中![]() =_____________(保留三位有效数字);已知:Ksp(BaCO3)=2.6×109,Ksp(BaSO4)=1.1×1010。
=_____________(保留三位有效数字);已知:Ksp(BaCO3)=2.6×109,Ksp(BaSO4)=1.1×1010。
(2)已知室温时,Ksp[Mg(OH)2]=4.0×1011。在0.1 mol/L的MgCl2溶液中,逐滴加入NaOH溶液,当Mg2+完全沉淀时,溶液的pH是_____________(已知lg2=0.3)。
【答案】23.6 11.3
【解析】
(1)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中同时存在BaSO4、BaCO3的沉淀溶解平衡,根据溶度积公式进行计算;
(2)0.1 mol/L的MgCl2溶液中,逐滴加入NaOH溶液,当Mg2+完全沉淀时,浓度应小于1.0×105mol/L,据此根据溶度积公式进行计算。
(1)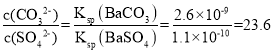 ;
;
故答案为:23.6;
(2)c(MgCl2)=0.1molL1,逐滴加入NaOH溶液,当Mg2+完全沉淀时,浓度应小于1.0×105mol/L,![]() ,
,![]() ,pH=-lgc(H+)=-lg
,pH=-lgc(H+)=-lg![]() =11.3;
=11.3;
故答案为:11.3。

【题目】1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
元素 | H | Li | Be | B | C | N | O | F |
电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
元素 | Na | Mg | Al | Si | P | S | Cl | K |
电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
请仔细分析,回答下列有关问题:
(1)估计钙元素的电负性的取值范围:___________< X <___________;
(2)据表中的所给数据分析,同主族内的不同元素X的值变化的规律是_____________________________;
(3)某元素的电负性数值为1.8,请你预测其可能具有的性质(填“金属性、非金属性”等)__________________________________;
(4)据上表电负性数据,试推断AlBr3中形成的化学键的类型为______________,试用电子式表示其形成过程___________________________________________________________。