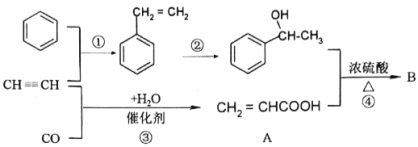
题目内容
【题目】某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g) + bB (g) ![]() cC(g) ΔH=-Q kJ·mol-1(Q>0)。12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如右图所示。下列说法正确的是
cC(g) ΔH=-Q kJ·mol-1(Q>0)。12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如右图所示。下列说法正确的是
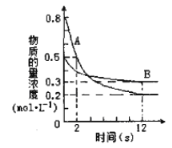
A.前12s内,A的平均反应速率为0.025mol·L-1·s-1
B.12s后,A的消耗速率等于B的生成速率
C.化学计量数之比b :c=1 :2
D.12s内,A和B反应放出的热量为0.2Q kJ
【答案】C
【解析】
试题分析:A、从反应开始到12s时,A的浓度变化量△c=0.8mol/L-0.2mol/L=0.6mol/L,时间为12s,故v(A)= ![]() =0.05mol/(Ls),故A错误;B、12s时,B的浓度变化量△c=0.5mol/L-0.3mol/L=0.2mol/L,故a:b=0.6:0.2=3:1,12s后达到平衡,A的消耗速率等于B的生成速率的3倍,故B错误;C、12s时,B的浓度变化量△c=0.5mol/L-0.3mol/L=0.2mol/L,故a:b=0.6:0.2=3:1,经测定前12s内生成C的物质的量为0.8mol,此时C浓度变化为:0.8mol/L÷2=0.4mol/L,b:c=0.2mol/L:0.4mol/L =1:2,故C正确;D.12s内,生成C的物质的量为0.8mol,及反应的A的物质的量为1.2mol,反应放出的热量为1.2Q kJ,故D错误;故选C。
=0.05mol/(Ls),故A错误;B、12s时,B的浓度变化量△c=0.5mol/L-0.3mol/L=0.2mol/L,故a:b=0.6:0.2=3:1,12s后达到平衡,A的消耗速率等于B的生成速率的3倍,故B错误;C、12s时,B的浓度变化量△c=0.5mol/L-0.3mol/L=0.2mol/L,故a:b=0.6:0.2=3:1,经测定前12s内生成C的物质的量为0.8mol,此时C浓度变化为:0.8mol/L÷2=0.4mol/L,b:c=0.2mol/L:0.4mol/L =1:2,故C正确;D.12s内,生成C的物质的量为0.8mol,及反应的A的物质的量为1.2mol,反应放出的热量为1.2Q kJ,故D错误;故选C。

练习册系列答案
相关题目