题目内容
【题目】
(1)需要称量NaOH固体 克;
(2)需量取密度为1.19g/cm3、质量分数为36.5%的浓盐酸________mL;
(3)定容时的操作是:继续向容量瓶中加蒸馏水至 ,改用胶头滴管滴加蒸馏水至 。
(4)配制过程中,下列实验操作导致所配制的稀盐酸的物质的量浓度偏大的有 。
A.量取浓盐酸时发现量筒不干净,用水洗净后直接量取 |
B.用量筒量取浓盐酸时仰视观察凹液面 |
C.稀释浓盐酸时,没有冷却就立即转移到容量瓶中 |
D.定容时俯视刻度线 |
E.加蒸馏水时不慎超过了刻度线,用胶体滴管吸出
F.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
【答案】(1)2.0(2)4.2
(3)距离刻度线1~2 cm时 凹液面最低处与刻线相切
(4)B C D
【解析】试题分析:(1)根据大而近原则,必须选择500mL容量瓶配制0.1 mol/L NaOH溶液,因此由m=nM=cVM计算时,不能按照如下方法计算0.1 mol/L×450×10-3L×40g/mol = 1.8g,应按0.1 mol/L × 500 × 10-3L × 40 g/mol = 2.0g(托盘天平的精确度为0.1g);设所需浓盐酸的体积为x mL,由ρVw可知溶质的质量为1.19 g/cm3×x mL×36.5%,由m=nM=cVM可知,溶质的质量为0.2 mol/L×250×10-3L×36.5g/mol,根据稀释前后溶质的质量相等可得:1.19 g/cm3×x mL×36.5% =" 0.2" mol/L×250×10-3L×36.5g/mol,解得:x="4.2" mL(量筒的精确度为0.1 mL);(3)定容时的操作是:继续向容量瓶中加蒸馏水至距离刻度线1~2 cm时,改用胶头滴管滴加蒸馏水至凹液面最低处与刻线相切;(4)误差分析的依据是![]() =c、控制变量法,对n的大小有(或没有)影响时,对V的大小就没有(或有)影响;A、量取浓盐酸时发现量筒不干净,用水洗净后直接量取,该情况将导致n偏小,但对V无影响,因此
=c、控制变量法,对n的大小有(或没有)影响时,对V的大小就没有(或有)影响;A、量取浓盐酸时发现量筒不干净,用水洗净后直接量取,该情况将导致n偏小,但对V无影响,因此![]() (即c)偏小;B、用量筒量取浓盐酸时仰视观察凹液面,该情况将导致n偏大,但对V无影响,因此
(即c)偏小;B、用量筒量取浓盐酸时仰视观察凹液面,该情况将导致n偏大,但对V无影响,因此![]() (即c)偏大;C、稀释浓盐酸时,没有冷却就立即转移到容量瓶中,该情况对n无影响,但热胀冷缩能使V偏小,因此
(即c)偏大;C、稀释浓盐酸时,没有冷却就立即转移到容量瓶中,该情况对n无影响,但热胀冷缩能使V偏小,因此![]() (即c)偏大;D、定容时,俯视刻度线,该情况导致V偏小,但对n无影响,因此因此
(即c)偏大;D、定容时,俯视刻度线,该情况导致V偏小,但对n无影响,因此因此![]() (即c)偏大;E、加蒸馏水时不慎超过了刻度线,用胶体滴管吸出,该情况导致V偏大,但对n无影响,因此因此
(即c)偏大;E、加蒸馏水时不慎超过了刻度线,用胶体滴管吸出,该情况导致V偏大,但对n无影响,因此因此![]() (即c)偏小;F、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,该情况导致V偏大,但对n无影响,因此因此
(即c)偏小;F、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,该情况导致V偏大,但对n无影响,因此因此![]() (即c)偏小;答案选BCD。
(即c)偏小;答案选BCD。

【题目】
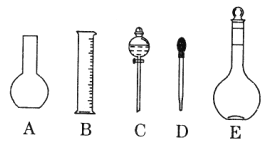
(1)如图所示的仪器中配制溶液肯定不需要的是____________(填序号),配制上述溶液还需用到的玻璃仪器是______________(填仪器名称)。
(2)容量瓶上需标有以下6项中的_________________(填序号)
① 温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥酸式或碱式
(3)容量瓶不_________(填序号)。
A.配制一定体积准确浓度的标准溶液 |
B.贮存溶液 |
C.测量容量瓶规格以下的任意体积的液体 |
D.准确稀释某一浓度的溶液 |
E.用来加热溶解固体溶质
(4)根据计算用托盘天平称取NaOH的质量为__________g。需用量筒量取质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为:__________mL(计算结果保留一位小数)。在配制过程中,下列操作中能引起误差偏高的有____________(填代号)。
① 未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中定容
② 定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
③ 定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
④ 定容时,俯视刻度线
【题目】X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
X | Y | Z | M | R | Q | |
原子半径 | 0.186 | 0.074 | 0.099 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
其他 | 阳离子无核外电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)X和M的原子可构成 18 电子的分子,该分子的结构式为 。
(2)R元素的单质与水反应的离子方程式是 。
(3)Z与Q相比,金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是 (填字母序号)。
a.Q的熔点比Z的熔点高,Q的硬度比Z的硬度大
b.Z与冷水反应迅速,而Q与冷水几乎不反应
c.Z的最高价氧化物对应水化物是强碱,而Q的最高价氧化物对应水化物具有两性
(4)与Y元素同主族的短周期元素E在自然界中存在多种核素,它们之间的关系互为 ,其中用于测定一些文物年代的核素的符号为 。
(5)写出Z2M2与X2M反应的化学方程式并标出电子转移关系。
