题目内容
1.下列反应或过程需要吸收能量的是( )| A. | H+H→H-H | B. | H-Cl→H+Cl | ||
| C. | Mg+2HCl=MgCl2+H2↑ | D. | H2SO4+2NaOH=Na2SO4+2H2O |
分析 A、形成化学键放出能量;
B、断开化学键吸收能量;
C、金属与酸的置换反应属于放热反应;
D、酸碱中和反应属于放热反应,据此解答即可.
解答 解:A、氢原子形成氢气,是形成H-H键,放出能量,故A错误;
B、断开H-Cl化学键需要吸收能量,故B正确;
C、镁与稀盐酸反应属于金属与酸的置换反应,放出能量,故C错误;
D、硫酸与氢氧化钠反应属于酸碱中和反应,放出能量,故D错误,
故选B.
点评 本题考查需要吸收能量的变化,难度不大,注意成键放出能量,断键吸收能量.

练习册系列答案
相关题目
11.下列叙述正确的是( )
| A. | 烷烃与烯烃不可能是同分异构体 | |
| B. | 同分异构体只能存在于有机化合物之间 | |
| C. | 乙酸和甲酸甲酯不互为同分异构体 | |
| D. | 乙醇、丙三醇互为同系物,同系物之间不可能互为同分异构体 |
9.如图是四种短周期元素在元素周期表中的相对位置,其中X和Y原子的质子数之和为(10n+m)、Z和W原子的核外电子数之和为(10m+n)(m、n均为正整数).下列说法正确的是( )
| X | Y | |
| Z | W |
| A. | X、Y、W三种元素的气态氢化物中,X的气态氢化物的水溶液碱性最强 | |
| B. | XW2的电子式为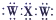 | |
| C. | 实验室制备YO2和WO2的发生装置都可用 | |
| D. | W和Y 的最高价氧化物对应的水化物的稀溶液溶解铁,表现出的性质相同 |
6.下表为部分短周期元素的性质或原子结构:
(1)写出元素X的离子结构示意图: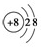 .写出元素Z的气态氢化物的化学式:NH3.
.写出元素Z的气态氢化物的化学式:NH3.
(2)Y元素最高价氧化物对应水化物的化学式Al(OH)3,该物质与NaOH溶液反应的化学方程式为Al(OH)3+OH-═[Al(OH)4]-.
(3)元素T与氯元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是C.
A.常温下氯气的颜色比T单质的颜色深
B.T的单质通入氯化钠水溶液不能置换出氯气
C.氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是Al,理由是只有Al具有金属性.
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层电子数是K层电子数的3倍 |
| Y | 第3周期元素的简单离子中半径最小 |
| Z | L层有5个电子 |
 .写出元素Z的气态氢化物的化学式:NH3.
.写出元素Z的气态氢化物的化学式:NH3.(2)Y元素最高价氧化物对应水化物的化学式Al(OH)3,该物质与NaOH溶液反应的化学方程式为Al(OH)3+OH-═[Al(OH)4]-.
(3)元素T与氯元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是C.
A.常温下氯气的颜色比T单质的颜色深
B.T的单质通入氯化钠水溶液不能置换出氯气
C.氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是Al,理由是只有Al具有金属性.
7.下列实验操作的先后顺序的说法正确的是( )
①加热试管时,先均匀加热,后局部加热;
②用排水法收集气体时,先移出导管后撤酒精灯;
③制取气体物质时,先检查装置气密性后装药品;
④使用分液漏斗前,先检查是否漏水后使用;
⑤用PH试纸检验溶液酸碱度时,先用蒸馏水将试纸湿润然后检验;
⑥使用托盘天平时,要先调零后称量;
⑦做H2还原CuO实验时,先通H2后加热CuO;反应完毕后,先撤酒精灯待试管冷却后停止通H2.
①加热试管时,先均匀加热,后局部加热;
②用排水法收集气体时,先移出导管后撤酒精灯;
③制取气体物质时,先检查装置气密性后装药品;
④使用分液漏斗前,先检查是否漏水后使用;
⑤用PH试纸检验溶液酸碱度时,先用蒸馏水将试纸湿润然后检验;
⑥使用托盘天平时,要先调零后称量;
⑦做H2还原CuO实验时,先通H2后加热CuO;反应完毕后,先撤酒精灯待试管冷却后停止通H2.
| A. | 全部正确 | B. | 除②以外 | C. | 除④以外 | D. | 除⑤以外 |
8.下列实验操作正确且能达到目的是( )
| A. | 将AlCl3溶液蒸发结晶提取无水AlCl3 | |
| B. | 用饱和的NaOH热溶液除去乙酸乙酯中的乙醇、乙酸 | |
| C. | 在温水瓶中加入Na2CO3溶液泡浸后加入盐酸除去内壁上CaSO4 | |
| D. | 将Cl2、HCl混合气体通过盛有NaHCO3饱和溶液的洗气瓶除去HCl |
 碳和水蒸汽的反应是吸热反应,如图所示是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量(E),试回答下列问题:
碳和水蒸汽的反应是吸热反应,如图所示是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量(E),试回答下列问题: