题目内容
【题目】对机动车尾气中的N元素、C 元素进行处理,可以保护环境,减少污染。
(1)汽缸中生成 NO 的反应为:N2(g)+O2(g) ![]() 2NO(g) △H>0,NOx在铑(Rh)的催化下最终转化为无毒的产物,其中NO与CO的反应过程中经历如下两步(已知:1kcal=4.18kJ):
2NO(g) △H>0,NOx在铑(Rh)的催化下最终转化为无毒的产物,其中NO与CO的反应过程中经历如下两步(已知:1kcal=4.18kJ):
反应Ⅰ:NO(g)+CO(g)+Rh(s)![]() RhN(s)+CO2(g) △H=-8kcal·mol-1
RhN(s)+CO2(g) △H=-8kcal·mol-1
反应Ⅱ:RhN(s)+NO(g)![]() Rh(s)+N2O(g) △H =-76.4kcal·mol-1
Rh(s)+N2O(g) △H =-76.4kcal·mol-1
则由NO生成1mol N2O的△H =____kcal·mol-1。若Ⅰ比Ⅱ的反应速率大,下列能正确表示反应2NO(g)+CO(g)![]() N2O(g)+CO2(g) △H在有催化剂(a)和无催化剂(b)时反应进程的能量变化图的是_____
N2O(g)+CO2(g) △H在有催化剂(a)和无催化剂(b)时反应进程的能量变化图的是_____

⑵在体积为1L的恒温密闭容器中,发生反应:
2NO(g)+2CO (g) ![]() N2(g)+2CO2(g),有关物质的量如下表:
N2(g)+2CO2(g),有关物质的量如下表:
起始物质的量/mol | 平衡物质的量/mol | |||
NO | CO | N2 | CO2 | CO2 |
0.2 | 0.2 | 0 | 0 | a |
①上述反应的化学平衡常数表达式K=__________
②若达到平衡后气体的压强为开始时的0.875倍,则a =______
⑶汽车使用乙醇汽油并不能减少NOx的排放,某研究小组在实验室以耐高温试剂Ag-ZSW-5催化,测得NO转化为N2的转化率随温度变化情况如下图所示。

①在n(NO)/n(CO)=1条件下,最佳温度应控制在_____左右。
②若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为___
③用平衡移动原理解释为什么加入CO后NO转化为N2的转化率增大?______
【答案】 -84.4 B ![]() 0.1 870K (860~880K 范围都可以) NO直接分解成N2的反应是放热反应,升高温度不利于反应进行 加入的CO与NO分解生成的O2反应,使NO分解平衡向生成N2的方向移动,因此NO转化率升高
0.1 870K (860~880K 范围都可以) NO直接分解成N2的反应是放热反应,升高温度不利于反应进行 加入的CO与NO分解生成的O2反应,使NO分解平衡向生成N2的方向移动,因此NO转化率升高
【解析】试题分析:本题考查化学反应中的能量变化和盖斯定律的应用,化学平衡常数表达式的书写和化学平衡的计算,图像分析,外界条件对化学平衡的影响。
(1)应用盖斯定律,反应I+反应II得2NO(g)+CO(g)=CO2(g)+N2O(g)ΔH=(-8kcal/mol)+(-76.4kcal/mol)=-84.4kcal/mol。使用催化剂能降低反应的活化能,使用催化剂时反应I、反应II以及总反应都是放热反应,反应I、反应II以及总反应的反应物的总能量大于相应生成物的总能量,符合题意的为B,答案选B。
(2)①根据化学方程式可写出化学平衡常数表达式K=![]() 。
。
②用三段式, 2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
n(起始)(mol) 0.2 0.2 0 0
n(转化)(mol) a a a/2 a
n(平衡)(mol) 0.2-a 0.2-a a/2 a
达到平衡后气体的压强为开始的0.875倍,0.2-a+0.2-a+a/2+a=0.875![]() (0.2+0.2),解得a=0.1。
(0.2+0.2),解得a=0.1。
(3)①根据图像n(NO)/n(CO)=1条件下,反应温度为870K左右时NO还原为N2的转化率已经很大,继续升高温度NO还原为N2的转化率增大不明显,最佳温度控制在870K左右。
②若不使用CO,则NO直接发生分解反应:2NO(g)![]() N2(g)+O2(g)ΔH
N2(g)+O2(g)ΔH![]() 0,温度超过775K时NO分解率降低的原因可能是:该反应为放热反应,升高温度平衡向逆反应方向移动,不利于NO转化为N2,NO的分解率降低。
0,温度超过775K时NO分解率降低的原因可能是:该反应为放热反应,升高温度平衡向逆反应方向移动,不利于NO转化为N2,NO的分解率降低。
③加入的CO与NO分解生成的O2反应,使NO分解平衡向生成N2的方向移动,NO的转化率升高,所以加入CO后NO转化为N2的转化率增大。

 名校课堂系列答案
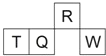
名校课堂系列答案【题目】有关化学键的键能(指将1mol气态分子拆开形成气态原子时,每个化学键断裂所需的最低能量)数据如表所示:
化学键 | C-H | C=C | H-H | C-C |
键能/(KJ/mol) | 413.4 | x | 436.0 | 347.7 |
已知CH2=CH2(g)+H2(g)![]() CH3CH3(g) ΔH=-123.5kJ/mol,x的值为
CH3CH3(g) ΔH=-123.5kJ/mol,x的值为
A. 136.8 B. 307.5 C. 615.0 D. 177.3