��Ŀ����
����Ŀ��ijdz��ɫ����X[x(NH4)2SO4��yFeSO4��zH2O]�ڷ�����ѧ�г�������ԭ��. Ϊȷ������ɣ�ijС��ͬѧ��������ʵ�飮
I��NH4+�IJⶨ
������������װ����ͼ��ʾ��
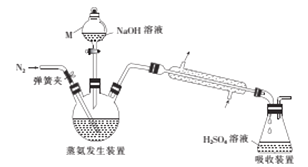
��ص�ʵ�鲽�����£�
��ȷ��ȡ58.80g����X����ˮ�ܽ����Һע��������ƿ�У�
��ȷ��ȡ50.00mL3.0300molL-1H2SO4��Һ����ƿ�У�
����������ƿ�м�������NaOH��Һ��ͨ�뵪��������������������ȡ����ƿ��
����0.120molL-1NaOH����Һ�ζ���ƿ�й��������ᣬ�ζ��յ�ʱ����25.00mL NaOH����Һ��
��1������M������Ϊ__________��
��2��������У�������������ԭ��Ӧ�Ļ�ѧ����ʽΪ____________������������Ϊ�˼���ʵ�����,����Ҫ��ֱ�������ܽ����������������������IJ���������_____________��
��3��������У�����ʱ��ƿ����Һ�彦����������õ�n(NH4+)��ֵ��______(����ƫ������ƫС������������)��
II.SO42-�����IJⶨ
����������������ʵ�鲽������:
����ȷ��ȡ58.80g����X ���ձ��У���ˮ�ܽ⣬�߽�����������BaCl2��Һ��
�ڽ��õ�����Һ������ֽ(�ҷ�������С,�ɺ���)���ˣ�ϴ�ӳ���3~4�Σ�
������ֽ�����ó���ȡ����������ֽ������ֽ��ȫ�һ���
�ܼ������ճ��������ء��������ó�������Ϊ69.90g��
��4���������,�ж�BeCl ��Һ�ѹ�����ʵ�������������___________��
��5���������,������ˮϴ����,����ҪĿ����___________��
��6�����ʵ����ͨ������ó�����X�Ļ�ѧʽΪ__________��ʵ��I �IJ������,��Һ�������ܶ��ɴ�С��˳��Ϊ___________��
���𰸡� ��Һ©�� 4Fe(OH)2+O2+2H2O=4Fe(OH)3 ������ˮ��ϴ��������ͨ��2~3 ������ϴ��Һע����ƿ�� ƫ�� ����Һ�ֲ��,ȡ���ϲ���Һ�������Թ��������Թ��м���1~2��BaCl2��Һ,���ް�ɫ���dz��֣���˵��BaCl2��Һ�ѹ���(��μ�Na2SO4��Һ�����ְ�ɫ��������Ҳ����) �����ܼ��ٳ������ܽ���ʧ����Сʵ����� (NH4)2SO4FeSO46H2O c(SO42-)>c(NH4+)>c(Fe2+ )>c(H+)>c(OH-)
��������I����1������M������Ϊ��Һ©������ȷ�𰸣���Һ©����
(2)�������������������ӷ�Ӧ��������������������ͨ������������Ϊ������������ѧ����ʽΪ4Fe(OH)2+O2+2H2O=4Fe(OH)3������������ֱ���������л����һЩҺ������Բⶨ�������Ӱ�죻���Ϊ�˼���ʵ�����,����Ҫ��ֱ�������ܽ��С������������������IJ���������������ˮ��ϴ��������ͨ��2~3�Σ���ϴ��Һע����ƿ�У���ȷ�𰸣�������ˮ��ϴ��������ͨ��2~3�Σ���ϴ��Һע����ƿ�С�
(3)������У�����ʱ��ƿ����Һ�彦���������������Ƶ�����С����ⶨ��ƿ����Һ��ʣ������������С���백����Ӧ������������࣬�������n(NH4+)����ƫ����ȷ�𰸣�ƫ��
II. ��4���ж��Ȼ����Ƿ�������������ϲ���Һ�м����μ��Ȼ�������û���µij���������˵����Һ��û����������ӣ����Ȼ����Ѿ���������ȷ�𰸣�����Һ�ֲ�����ϲ���Һ�м���1��2��BaCl2��Һ���ް�ɫ���dz��֣���BaCl2��Һ�ѹ�����
(5) ����ˮϴ�ӿ��Լ��ٹ�����ܽ⣬������ϴ�ӻ�ʹ�����ϸ�����������ӣ���Һ��Ҳ������������ӣ����Բ�����������Һϴ�ӳ�����Ӧ��ѡ����ˮϴ��������ҪĿ���Ǿ����ܼ��ٳ������ܽ���ʧ����Сʵ������ȷ�𰸣������ܼ��ٳ������ܽ���ʧ����Сʵ����
(6) ��NaOH��Ӧ����������ʵ���Ϊn��H2SO4��=1/2n(NaOH)=1/2��0.04��0.025=0.0005 mol���백����Ӧ����������ʵ���Ϊ��0.05��1.0100��1/2��0.0400��0.02500=0.05mol�����������ʵ���n��NH3��=2n��H2SO4��=0.1mol��19.60g����X���ձ��У���ˮ�ܽ⣬�߽����������� BaCl2��Һ���õ����ᱵ����23.30g����n��SO42-��=23.3/233=0.1 mol��19.6��2x /(132x+152y+18z)=0.1��19.6��(x+y)/(132x+152y+18z)=0.1����x+y=2x����x=y����x=1����19.6��2/(132+152+18 z)=0.1�� ��z=6�� ��x=1��y=1��z=6�����仯ѧʽΪ��NH4��2SO4FeSO46H2O����x=2����19.6��4/(132��2+152��2+18 z)=0.1�� ��z=1.21�������ϣ����Ծ���X�Ļ�ѧʽΪ(NH4)2SO4��FeSO4��6H2O��������(NH4)2SO4��FeSO4��6H2O ��ˮ�ܽ��笠���������������ˮ���������������ˮ��������笠�����Ũ������������c(NH4+)>c(Fe2+)����������������Ӳ�ˮ��������c(SO42-)>c(NH4+)��ʵ��I�IJ������,��Һ�������ܶ��ɴ�С��˳��c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-)����ȷ�𰸣�(NH4)2SO4��FeSO4��6H2O��c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-)��

 �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д� Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�